-
NF3是一种温室气体,其存储能量能力是CO2的12000〜20000倍,在大气中的寿命可长达740年,如表所示是几种化学键的键能,下列说法中正确的是
化学键
N≡N
F—F
N—F
键能/kJ·mol-1
946
154.8
283.0
A. 过程N2(g)→2N(g)放出能量
B. 过程N(g) + 3F(g)→NF3(g)放出能量
C. 反应N2(g) + 3F2(g)→2NF3(g)为吸热反应
D. NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
难度: 简单查看答案及解析
-
下列说法正确的是
A. 通过化学变化可以实现16O与18O之间的转化
B. 因为H2O的沸点高于H2S,所以O原子得电子能力大于S原子
C. 某化合物熔融状态下能导电,该化合物中一定有离子键
D. 16O2与18O2互为同素异形体
难度: 中等查看答案及解析
-
化学与生活,社会发展息息相关,下列有关说法不正确的是( )
A. 14C可用于文物年代的鉴定,12C和14C互为同位素
B. 甲烷的燃烧热很高,是较清洁的燃料,但它是温室气体
C. 在元素周期表中所含元素种类最多的族是IIIB族
D. 碱金属元素自上而下金属性逐渐增强,熔沸点依次升高
难度: 简单查看答案及解析
-
对于反应4NH3+5O2=4NO+6H2O,下列为4种不同情况下测得的反应速率中,表明该反应进行最快的是
A.v(NH3)=0.2 mol/(L·s) B.v(O2)=1.4 mol/(L·min)
C.v(H2O)=0.25 mol/(L·s) D.v(NO)=9 mol/(L·min)
难度: 简单查看答案及解析
-
肼(N2H4)是火箭常用的高能燃料,常温下,为液体。一定条件,肼与双氧水可发生反应N2H4+2H2O2=N2↑+4H2O。用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LN2中所含电子的总数为5NA
B.标准状况下,22.4LN2H4中所含原子的总数为6NA
C.标准状况下,3.2gN2H4中含有共价键的数目为0.6NA
D.若生成3.6gH2O,则上述反应中转移电子的数目为0.2NA
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.H2O2的电子式:H+[
]2-H+ B.Cl-的结构示意图:
C.原子核中有10个中子的氧离子:188O2— D.HClO的结构式H-Cl-O
难度: 简单查看答案及解析
-
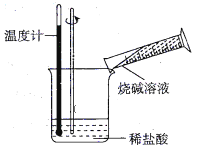
下列变化过程,属于放热反应的是( )
①液态水变成水蒸气②Ba(OH)2·8H2O与NH4Cl的反应 ③Al与四氧化三铁高温下反应 ④固体NaOH溶于水 ⑤ H2 在 Cl2 中燃烧 ⑥食物腐败
A.②⑤⑥ B.②③④ C.③④⑤ D.③⑤⑥
难度: 简单查看答案及解析
-
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是( )
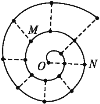
A. 离O点越远的元素原子半径越大
B. 虚线相连的元素处于同一族
C. N点代表的是图中金属性最强的元素
D. M、N点代表的元素组成的化合物中可能含有共价键
难度: 简单查看答案及解析
-
硒(Se)是人体健康必需的一种微量元素,已知Se的原子结构示意图如图:下列说法不正确的是( )
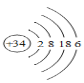
A.该元素处于第四周期第ⅥA族
B.SeO2既有氧化性又有还原性
C.酸性:H2SO4>H2SeO4
D.该原子的质量数为34
难度: 简单查看答案及解析
-
下列关于碱金属或卤族元素的叙述中,正确的是( )
A. 碱金属单质都可保存在煤油中
B. Rb比Na活泼,故Rb可以从NaCl溶液中置换出Na
C. 砹(At)是第六周期的卤族元素,根据卤素性质的递变规律,还原性:HAt>HI
D. 卤素单质与水反应的通式为X2+H2O= HX+HXO
难度: 简单查看答案及解析
-
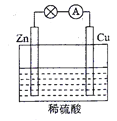
如图所示的8个装置属于原电池的是
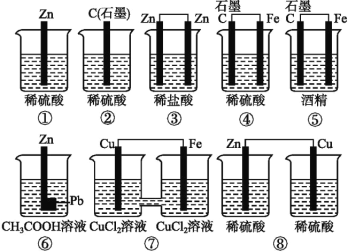
A. ①④⑤ B. ②③⑥ C. ④⑥⑦ D. ⑥⑦⑧
难度: 简单查看答案及解析
-
如图为发光二极管连接柠檬电池装置,下列说法正确的是( )
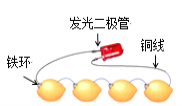
A.铁环作为柠檬电池的正极
B.电子由发光二极管经导线流向Fe环
C.负极的电极反应为:Fe-2e-=Fe2+
D.可将柠檬替换成盛装酒精溶液的装置
难度: 中等查看答案及解析
-
将10 mol H2和5 mol N2放入10 L真空密闭容器内,一定温度下发生如下反应:3H2(g)+N2(g)
2NH3(g),在最初的0.2 s内,消耗H2的平均速率为0.06 mol·L−1·s−1,则在0.2 s末,容器中NH3的物质的量是
A. 0.12 mol B. 0.08 mol C. 0.04 mol D. 0.8 mol
难度: 简单查看答案及解析
-
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列叙述错误的是
A. T的氧化物能与碱反应
B. 元素的非金属性:Q强于W
C. W的单质共热时,能与其最高价氧化物的水化物浓溶液反应
D. 原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物
难度: 简单查看答案及解析
-
某原电池总反应的离子方程式为:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeC13溶液
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液
C.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液
D.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
难度: 简单查看答案及解析
-
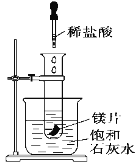
下列实验现象不能充分说明相应的化学反应是放热反应的是
选项
A
B
C
D
反应装置或图像
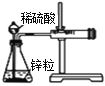
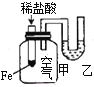
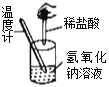
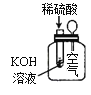
实验现象或图像信息
反应开始后,针筒活塞向右移动
反应开始后,甲侧液面低于乙侧液面
温度计的水银柱上升
反应开始后,气球慢慢胀大
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是
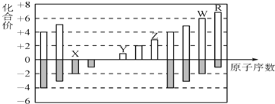
A.离子半径: X>Y>Z
B.WX3和水反应形成的化合物是离子化合物
C.最高价氧化物对应的水化物酸性:R>W
D.Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.17 g OH- 含有的质子数为9NA
B.2 L 0.5 mol·L-1 CH3COOH溶液中,CH3COO- 的数目为NA
C.标准状况下,22.4 L HF含有的共价键数为NA
D.2.0 g H218O与D2O的混合物中所含中子数为0.1NA
难度: 简单查看答案及解析
-
LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
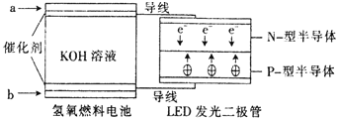
A. a外通入氧气,b处通氢气
B. 通入H2的电极发生反应:H2−2e−===2H+
C. 通入O2的电极发生反应:O2+4e−+2H2O===4OH−
D. 该装置将化学能最终转化为电能
难度: 困难查看答案及解析
-
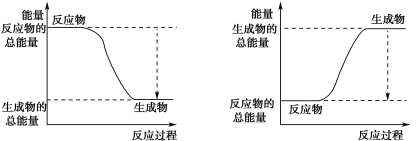
某反应由两步反应A→B→C构成,它的反应能量曲线如图,下列叙述正确的是( )
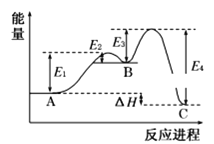
A.两步反应均为吸热反应
B.A与C的能量差为E4
C.三种化合物中的稳定性B﹤A﹤C
D.A→B反应,反应条件一定要加热
难度: 中等查看答案及解析
-
在一定温度下,向aL密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g),下列说法中:
①容器内压强不随时间变化,②容器内各物质的浓度不随时间变化,
③容器内X、Y、Z的浓度之比为1:2:2,
④单位时间消耗0.1mol X同时生成0.2mol Z,能判断此反应达到平衡的标志的是
A. ①② B. ①③ C. ②③ D. ②④
难度: 简单查看答案及解析