-
化学与生活、能源、环境等密切相关。下列描述错误的是( )
A.采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体
B.“雾霾天气”“温室效应”“光化学烟雾”的形成都与氮的氧化物无关
C.利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染
D.氮化硅陶瓷是一种新型无机非金属材料
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的数值。下列说法正确的是( )
A.2gD2O与2gH218O含有的中子数均为NA
B.1L0.1mol·L-1Na2S溶液中S2-和H2S的数目之和为0.1NA
C.漂白粉中加入浓盐酸,每生成1molCl2,转移的电子数2NA
D.常温下,将1molNO2气体加压生成N2O4的分子数为0.5NA
难度: 简单查看答案及解析
-
分子式为C4H8O2且能与氢氧化钠溶液反应的有机物(不考虑立体异构和醛类物质)有( )
A.2种 B.4种 C.6种 D.8种
难度: 困难查看答案及解析
-
向含有0.2molFeI2的溶液中加入a molBr2。下列叙述不正确的是( )
A.当a=0.1时,发生的反应为2I-+Br2=I2+2Br-
B.当a=0.25时,发生的反应为2Fe2++4I-+3Br2=2Fe3++2I2+6Br-
C.当溶液中I-有一半被氧化时,c(I-):c(Br-)=1:1
D.当0.2<a<0.3时,溶液中各离子浓度的关系为2c(Fe2+)+3c(Fe3+)+c(H+)=c(Br-)+c(OH-)
难度: 极难查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子的最外层电子数之和为12,Y、Z、W位于同一周期,Z原子的最外层电子数既是X原子内层电子总数的3倍,又是Y原子最外层电子数的3倍。下列说法不正确的是( )
A.原子半径:Y>X,离子半径Z<W
B.元素Y的单质能与元素X的最高价氧化物发生置换反应
C.元素Y和W能形成YW2型离子化合物
D.W的单质有毒,能使湿润的有色布条褪色
难度: 中等查看答案及解析
-
下列实验操作能达到相应实验目的的是( )
选项
实验操作
实验目的
A
将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化
证明二氧化硫具有漂白性
B
向2mL 1 mol·L-1NaOH溶液中先加入3滴1 mol·L-1 FeCl3,再加入3滴1 mol·L-1MgCl2溶液
证明K[Mg(OH)2]> K[Fe(OH)3]
C
相同条件下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液
探究Cu2+、Fe3+对H2O2分解速率的影响
D
向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴NaClO的84消毒液,观察红色褪色的快慢
证明溶液pH的减少,84消毒液的氧化能力增强
难度: 困难查看答案及解析
-
常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1的MOH溶液,如中所示曲线表示混合溶液的pH变化情况。下列说法中正确的是( )
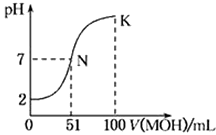
A.HA为一元弱酸,MOH为一元强碱
B.滴入MOH溶液的体积为50 mL时,c(M+)>c(A-)
C.N点水的电离程度大于K点水的电离程度
D.K点时,c(MOH)+ c(M+)=0.02 mol·L-1
难度: 困难查看答案及解析
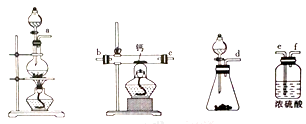
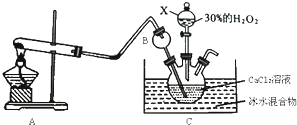

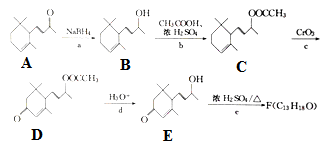
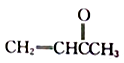 为原料制备聚1,3—丁二烯-{CH2-CH=CH-CH2}-n的合成路线。
为原料制备聚1,3—丁二烯-{CH2-CH=CH-CH2}-n的合成路线。