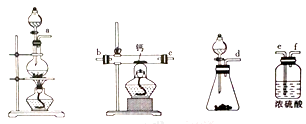-
过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
| 操作 | 现象 |
| 向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
| 取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2 CaO2。
CaO2。
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。
①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。
-
过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚或碱性溶液,但溶于酸。某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
| 操作 | 现象 |
| 向盛有4g CaO2的大试管中加入10mL稀盐酸的溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴石蕊 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
① CaO2与盐酸反应的化学方程式为 _____ 。
②加入石蕊后溶液褪色可能是因为溶液a中存在较多的 _____ 。
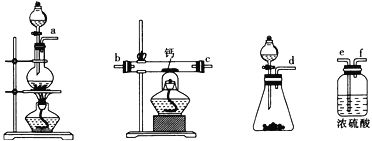
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2 CaO2
CaO2
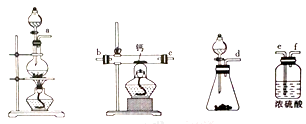
①请选择实验所需的装置,按气流方向连接的顺序为 (填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:I.检验装置的气密性后,装入药品;II.打开分液漏斗活塞,通入气体一段时间,加热药品;III反应结束后, (填操作);IV拆除装置,取出产物。
(3)利用反应Ca2++ H2O2+8H2O+NH3= CaO2·8H2O↓+2NH4+。在碱性环境下制取CaO2的装置如图所示。
①NH3在Ca2+和 H2O2 的反应过程中所起的作用是 。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O,过滤所需要的玻璃仪器是 ;将沉淀进行洗涤的操作为 。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强: 。
-
过氧化钙是重要的化工原料,易溶于酸、难溶于水、乙醇等溶剂,温度在350℃以上容易分解。其主要用作杀菌剂、防腐剂、解酸剂、油类漂白剂等。农业上用作种子及谷物的无毒性消毒剂及鱼池的增氧剂。
(1)过氧化钙工业上常用以下合成路线进行合成。
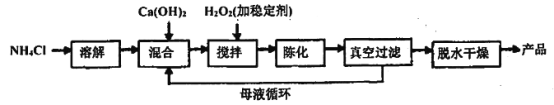
已知:氯化铵的作用是提高Ca2+的浓度。
①反应温度需要控制在常温下产率最高,温度过高或过低都会使产率降低的原因是___________________,母液的主要溶质是__________。
②整个过程的总化学方程式为_____________________________________________。
(2)实验室也可利用反应Ca(s)+O2(g) CaO2(s),在纯氧条件下制取CaO2。其装置示意图如下:
CaO2(s),在纯氧条件下制取CaO2。其装置示意图如下:
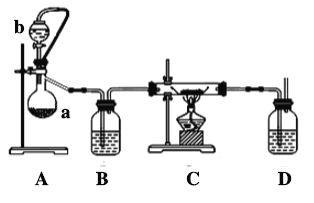
请回答下列问题:
①仪器a的名称为________,仪器a上方橡皮管的作用是______________,D装置中的试剂为________。
②根据完整的实验装置进行实验,实验步骤如下:检验装置的气密性后,装入药品;打开分液漏斗活塞,通入一段时间气体,加热药品;待反应结束后,操作顺序为____________(填序号);拆除装置,取出产物。
a 停止通入氧气并关闭分液漏斗的活塞 b 熄灭酒精灯 c 反应管冷却至室温
(3)利用如图装置测定反应2CaO2 2CaO+O2↑产品中CaO2含量时,停止反应且冷却至25℃后的装置如图所示。A装置中存在的错误是___________,若B装置直接读数确定25℃、1个标准大气压下气体的体积,则测量结果_______(填“偏大”、“偏小”或“无影响”)。
2CaO+O2↑产品中CaO2含量时,停止反应且冷却至25℃后的装置如图所示。A装置中存在的错误是___________,若B装置直接读数确定25℃、1个标准大气压下气体的体积,则测量结果_______(填“偏大”、“偏小”或“无影响”)。

-
纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输.
已知:①在潮湿空气中CaO2能够发生反应:CaO2+2H2O→Ca(OH)2+H2O2 2CaO2+2CO2→2CaCO3+O2
②CaO2与稀酸反应生成盐和H2O2:CaO2+2H+→Ca2++H2O2
在实验室可用钙盐制取CaO2•8H2O,再经脱水制得CaO2.CaO2•8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2.
其制备过程如下:
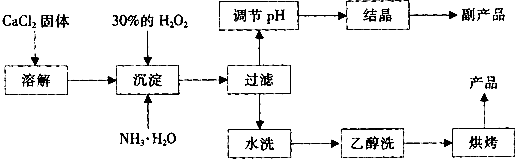
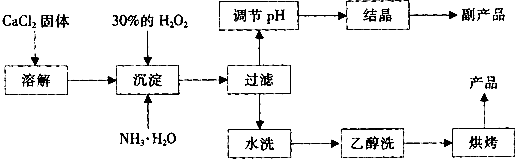
根据以上信息,回答下列问题:
(1)用上述方法制取CaO2•8H2O的化学方程式是______;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是______;
(3)该制法的副产品为______(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是______. A.盐酸 B.氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加______.
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步,向上述锥形瓶中加入几滴淀粉溶液.
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.(已知:I2+2S2O32-→2I-+S4O62-(无色))
①第三步中说明反应恰好完全的现象是______;②CaO2的质量分数为______ (用字母表示).
-
纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输.
已知:①在潮湿空气中CaO2能够发生反应:CaO2+2H2O→Ca(OH)2+H2O2 2CaO2+2CO2→2CaCO3+O2
②CaO2与稀酸反应生成盐和H2O2:CaO2+2H+→Ca2++H2O2
在实验室可用钙盐制取CaO2•8H2O,再经脱水制得CaO2.CaO2•8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2.
其制备过程如下:
根据以上信息,回答下列问题:
(1)用上述方法制取CaO2•8H2O的化学方程式是______;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是______;
(3)该制法的副产品为______(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是______. A.盐酸 B.氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加______.
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步,向上述锥形瓶中加入几滴淀粉溶液.
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.(已知:I2+2S2O32-→2I-+S4O62-(无色))
①第三步中说明反应恰好完全的现象是______;②CaO2的质量分数为______ (用字母表示).
-
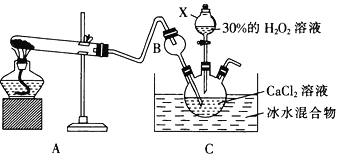
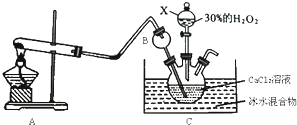
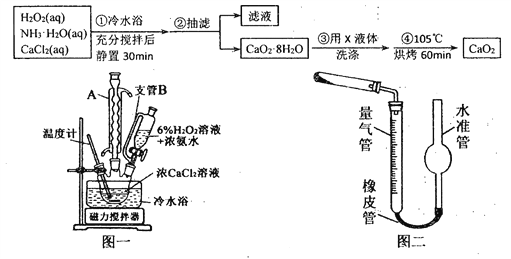
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:
请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为:___________________________;
(2)仪器A的名称___________________,三颈烧瓶右口连接的是恒压分液漏斗,其支管B的作用是____________________________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是__________(填写正确答案的序号,下同)
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这利用了过氧化钙以下哪些性质____________;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体),准确称取1.000g样品,置于试管中加热使其完全分解,收集到67.20mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为_________(保留4位有效数字);
-
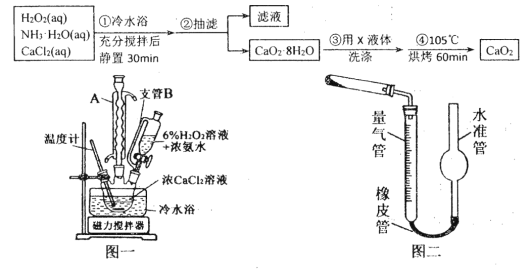
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:
请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为:_______________________________;
(2)仪器A的名称___________________,三颈烧瓶右口连接的是恒压分液漏斗,其支管B的作用是____________________________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是__________(填写正确答案的序号,下同)
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这利用了过氧化钙以下哪些性质____________;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体),准确称取1.000g样品,置于试管中加热使其完全分解,收集到67.20mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为_________ (保留4位有效数字);
-
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图 如下:

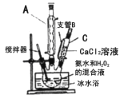
已知:CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O= CaO2•8H2O↓+2NH4Cl
请回答下列问题:
(1)仪器A的名称为__________,仪器C支管B的作用____________;
(2)加入氨水的作用是_______;(从化学平衡移动的原理分析)
(3)过滤后洗涤沉淀的试剂最好用_______;
A.水 B.浓盐酸 C.无水乙醇 D.CaCl2溶液
(4)沉淀反应时常用冰水浴控制温度在O℃左右,其可能原因是_________、_______(写出两种)。
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
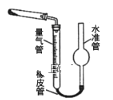
①检查该装置气密性的方法是:________________;
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
-
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图如下:
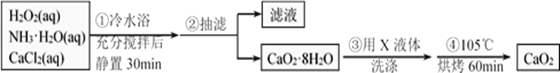

请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为________________;
(2)支管B的作用是__________;加入氨水的作用是________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙_____________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
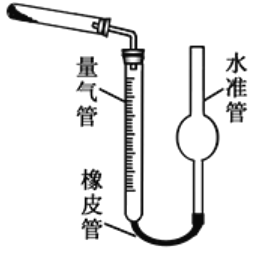
①检查该装置气密性的方法是:____________________;
②使用分析天平准确称取0.5000g样品,置于试管中加热使其完全分解,收集到 33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为_________(保留4位有效数字);
-
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图如下:
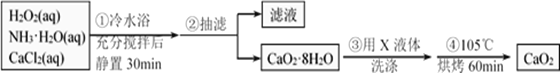

请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为________________;
(2)支管B的作用是__________;加入氨水的作用是________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙_____________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
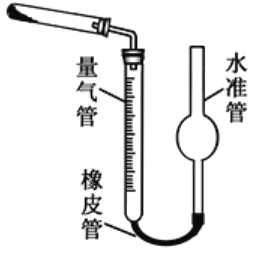
①检查该装置气密性的方法是:____________________;
②使用分析天平准确称取0.5000g样品,置于试管中加热使其完全分解,收集到 33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为_________(保留4位有效数字);
CaO2