-
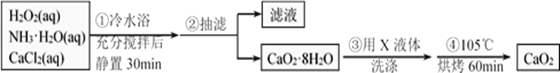
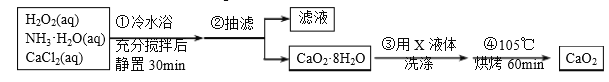
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:
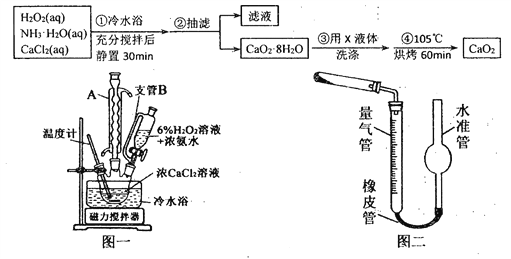
请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为:___________________________;
(2)仪器A的名称___________________,三颈烧瓶右口连接的是恒压分液漏斗,其支管B的作用是____________________________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是__________(填写正确答案的序号,下同)
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这利用了过氧化钙以下哪些性质____________;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
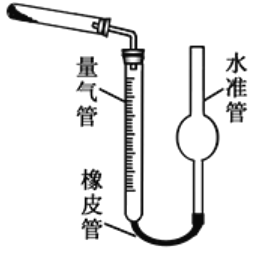
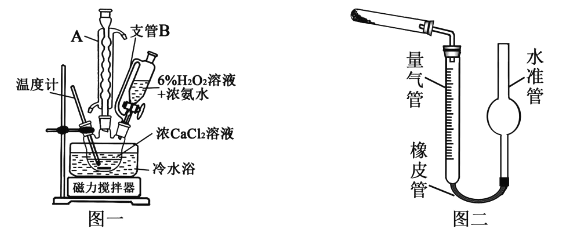
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体),准确称取1.000g样品,置于试管中加热使其完全分解,收集到67.20mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为_________(保留4位有效数字);
-
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:
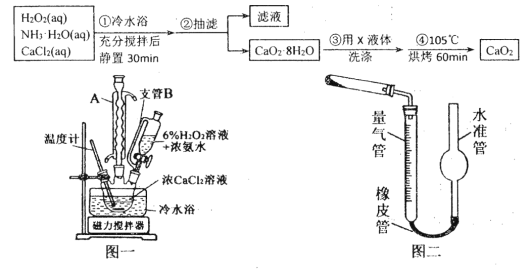
请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为:_______________________________;
(2)仪器A的名称___________________,三颈烧瓶右口连接的是恒压分液漏斗,其支管B的作用是____________________________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是__________(填写正确答案的序号,下同)
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这利用了过氧化钙以下哪些性质____________;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体),准确称取1.000g样品,置于试管中加热使其完全分解,收集到67.20mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为_________ (保留4位有效数字);
-
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图 如下:

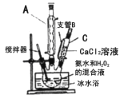
已知:CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O= CaO2•8H2O↓+2NH4Cl
请回答下列问题:
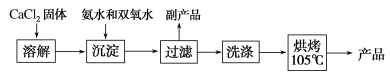
(1)仪器A的名称为__________,仪器C支管B的作用____________;
(2)加入氨水的作用是_______;(从化学平衡移动的原理分析)
(3)过滤后洗涤沉淀的试剂最好用_______;
A.水 B.浓盐酸 C.无水乙醇 D.CaCl2溶液
(4)沉淀反应时常用冰水浴控制温度在O℃左右,其可能原因是_________、_______(写出两种)。
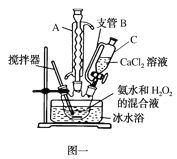
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
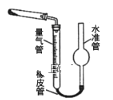
①检查该装置气密性的方法是:________________;
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
-
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。
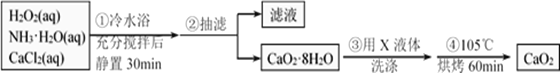
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图如下:

请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为________________;
(2)支管B的作用是__________;加入氨水的作用是________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙_____________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
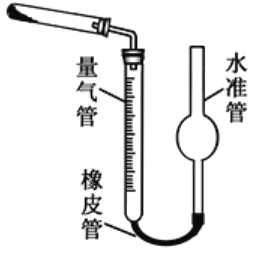
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:____________________;
②使用分析天平准确称取0.5000g样品,置于试管中加热使其完全分解,收集到 33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为_________(保留4位有效数字);
-
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图如下:

请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为________________;
(2)支管B的作用是__________;加入氨水的作用是________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙_____________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:____________________;
②使用分析天平准确称取0.5000g样品,置于试管中加热使其完全分解,收集到 33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为_________(保留4位有效数字);
-
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如图:
已知:CaO2的制备原理:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl
请回答下列问题:
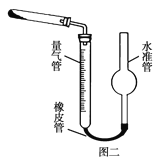
(1)仪器C的名称为__,支管B的作用__。
(2)加入氨水的作用是__。(从化学平衡移动的原理分析)
(3)过滤后洗涤沉淀的试剂最好用___。
A.水 B.浓盐酸 C.无水乙醇 D.CaCl2溶液
(4)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是__、__(写出两种)。
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体):
①检查该装置气密性的方法是:__。
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为__(保留4位有效数字)。
-
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一) 如下:

已知: CaO2的制备原理: CaCl2+H2O2+2NH3•H2O+6H2O= CaO2•8H2O↓+2NH4Cl
请回答下列问题:
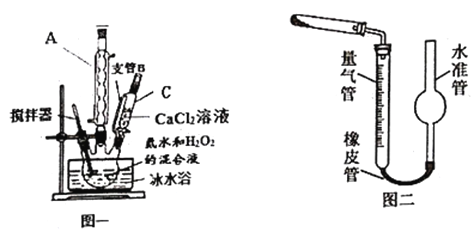
(1)仪器C的名称为__________,支管B的作用____________;
(2)加入氨水的作用是_______; (从化学平衡移动的原理分析)
(3)过滤后洗涤沉淀的试剂最好用_______;
A.水 B.浓盐酸 C.无水乙醇 D.CaCl2溶液
(4)沉淀反应时常用冰水浴控制温度在O℃左右,其可能原因是_________、_______(写出两种)。
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:________________;
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4 位有效数字);
-
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在破性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一) 如下:

请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为___________________________________;
(2)支管B 的作用是___________________________________;
(3)步骤3中洗涤CaO2·8H2O的液体X 的最佳选择是______;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙___________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法________________________;②使用______(填仪器名称)准确称取0.5000g 样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况) 气体,则产品中过氧化钙的质量分数为__________________(保留4 位有效数字)
-
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在破性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一) 如下:

请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为___________________________________;
(2)支管B 的作用是___________________________________;
(3)步骤3中洗涤CaO2·8H2O的液体X 的最佳选择是______;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙___________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法________________________;②使用______(填仪器名称)准确称取0.5000g 样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况) 气体,则产品中过氧化钙的质量分数为__________________(保留4 位有效数字)
-
过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。
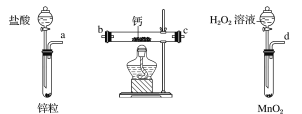
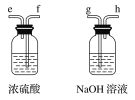
(1)请选择必要的装置,按气流方向连接顺序为_____________(填仪器接口的字母编号,装置可重复使用)。
(2)根据完整的实验装置进行实验,实验步骤如下:①检验装置的气密性后,装入药品;②打开分液漏斗活塞通入一段时间气体,加热药品;③反应结束后,_______________(填操作);④拆除装置,取出产物。
(3)一小组同学利用CaCl2在碱性条件下与H2O2反应制得。制备CaO2的实验方案和装置示意图如下:

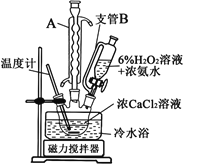
①三颈烧瓶中发生的主要反应的化学方程式为___________________________________;
②支管B的作用是_________________________;
③步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
④该反应常用冰水浴控制温度在0℃左右,其可能的原因该反应是放热反应,温度低有利于提高CaO2·8H2O产率;________________________________________。
(4)测定产品中CaO2含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴________(作指示剂)。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2 次,得出三次平均消耗Na2S2O3溶液的体积为V mL。
CaO2的质量分数为________(用字母表示)。(已知:I2 + 2S2O ===2I-+ S4O
===2I-+ S4O )
)























