-
下列对有机物结构或性质的描述,错误的是
A.可以用酸性高锰酸钾溶液除去乙烷中混有的乙烯
B.将溴水加入苯中,溴水的颜色变浅,这是由于发生了萃取
C.乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O
D.一定条件下,Cl2在甲苯的苯环或侧链上均可发生取代反应
难度: 中等查看答案及解析
-
下列化学用语或模型正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 乙醇的化学式:C2H5OH
C. 钙离子的结构示意图:
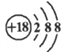 D. CH4分子的比例模型
D. CH4分子的比例模型
难度: 中等查看答案及解析
-
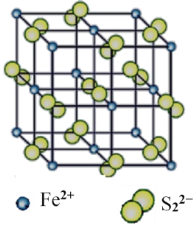
现有四种晶体,其离子排列方式如图所示,其中化学式正确的是( )
A.
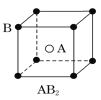 B.
B. 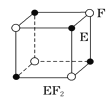 C.
C. 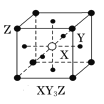 D.
D. 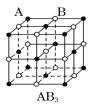
难度: 中等查看答案及解析
-
对于实验室制备乙烯的实验,下列说法正确的是
A.所用的反应药品为1体积酒精和3体积浓度为1mol/L的硫酸
B.收集乙烯可用排水法,也可用排空气法
C.温度计要插入反应液体的液面下
D.加热时要缓慢加热到170℃
难度: 简单查看答案及解析
-
下列说法中不正确的一组是( )
A. 甘油和乙醇互为同系物
B. CH2=CHCH2CH3 和 CH3CH=CHCH3 互为同分异构体
C.
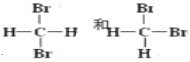 是同一种物质
是同一种物质D. O2 和 O3 互为同素异形体
难度: 中等查看答案及解析
-
有机物CH3CH2C(CH3)2CH(C2H5)CH3的准确命名是
A.3,4—二甲基—4—己基戊烷 B.3,3,4—三甲基己烷
C.3,4,4—三甲基己烷 D.2,3,3—三甲基己烷
难度: 简单查看答案及解析
-
根据等电子原理,下列各对粒子中,分子空间结构不相似的是( )
A.SO2与O3 B.H2O与NH3 C.NH4+与CH4 D.CO2与N2O
难度: 中等查看答案及解析
-
“绿色化学”对化学反应提出了“原子经济性”(原子节约)的概念及要求。理想的“原子经济性”反应中,原料分子中的所有原子全部转变成所需产物,不产生副产物,实现零排放。以下反应中符合“原子经济性”的是
A.乙醇催化氧化制乙醛
B.乙醇与浓硫酸共热制乙烯
C.苯乙烯在一定条件下制聚苯乙烯
D.乙烷与氯气反应制氯乙烷
难度: 简单查看答案及解析
-
下表是某些原子晶体的熔点和硬度,分析表中的数据,判断下列叙述正确的是( )
原子晶体
金刚石
氮化硼
碳化硅
石英
硅
锗
熔点/℃
3 900
3 000
2 700
1 710
1 410
1 211
硬度
10
9.5
9.5
7
6.5
6.0
①构成原子晶体的原子种类越多,晶体的熔点越高
②构成原子晶体的原子间的共价键的键能越大,晶体的熔点越高
③构成原子晶体的原子半径越大,晶体的硬度越大
④构成原子晶体的原子半径越小,晶体的硬度越大
A.①② B.③④ C.①③ D.②④
难度: 简单查看答案及解析
-
下列实验能达到实验目的的是( )
选项
实验
目的
A
将乙酸乙酯粗产品溶于氢氧化钠溶液中,分液
提纯乙酸乙酯
B
在100mL乙醇、100mL水中分别加入大小相近的钠粒
证明水中H—O键比乙醇中H—O键易断裂
C
将一定量苯和溴化铁、溴水混合
制备溴苯
D
向酸性高锰酸钾溶液中通入乙烯
证明乙烯具有漂白性
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列各对物质,化学键完全相同的是
①NaCl和NaOH②
和
③
和
④
和
⑤晶体硅和水晶
A.②④ B.①②③ C.② D.②④⑤
难度: 中等查看答案及解析
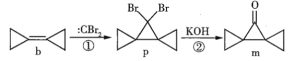
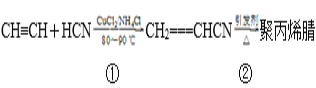
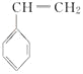 )反应得到一种优良的塑料,该塑料的结构简式为_________________________________。
)反应得到一种优良的塑料,该塑料的结构简式为_________________________________。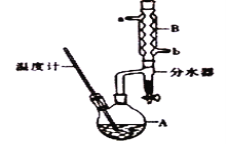


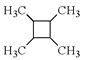 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_____。
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_____。