-
铁及铁的化合物在生活、生产中具有广泛应用,如亚铁氰化钾即K4[Fe(CN)6]是食盐中常用的抗结剂、铁基(氟掺杂镨氧铁砷化合物)是高温超导材料、“愚人金”是制备硫酸的主要矿物原料。请按要求回答下列问题。
(1)K4[Fe(CN)6]配合物中存在的作用力类型有__________________________(从“金属键”、“离子键”、“共价键”、“配位键”、“氢键”、“范德华力”中选填);其中CN-中各原子最外层均满足8电子稳定结构,其电子式为_____________,其中C原子的杂化形式是_________。
(2)铁基化合物中氟、氧、砷三种元素中电负性值由大到小的顺序是_____________(填元素符号)。其中氢化物(RH3)的某种性能(M)随R的核电荷数的变化趋势如图所示,则纵轴M可能表示为_____________________(从“沸点”、“稳定性”、“分子间作用力”、“R—H键能”中选填)。

(3)FeCl3晶体熔点为306℃,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:____________________________________________。
(4)“愚人金”是铁硫化合物,其晶体的晶胞如图所示。该晶体的化学式______________。
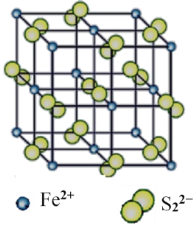
-
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] ?3H2O。
42.2g K4[Fe(CN)6] ?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。试回答下列问题:
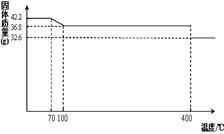
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol?L-1的KCN(pH>7)溶液与0.01mol?L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol?L-1(填“>”、“<”或“=”)。
(4)在25℃下,KCN溶液pH=9,c(K+)-c(CN_)="_______" mol?L-1(用数字表示但不需近似计算)。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-38。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于________。
(提示:当某离子浓度小于10-5 mol?L-1时可以认为该离子沉淀完全了;)
-
(8分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
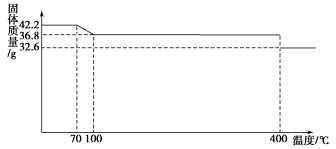
试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_____________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为__________________________。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_____________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
-
亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)Fe3+的核外电子排布式_________;
(2)与CN-互为等电子体的分子是______,K4[Fe(CN)6]中的作用力除离子键和共价键外,还有_______。含有12mol σ键的K4[Fe(CN)6]的物质的量为_______mol。
(3)黄血盐中C原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________;
(4)Fe、Na、K的晶体结构如图所示。
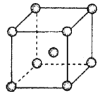
①钠的熔点比钾更高,原因是__________;
②Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_____g/cm3。
-
亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_________。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______和________。含有12mol σ键的K4[Fe(CN)6的物质的量为________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为_____,电负性由大到小的排序为________。
(4)Fe、Na、K的晶体结构如图所示:
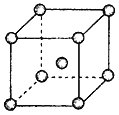
① 钠的熔点比钾更高,原因是__________________________。
② Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
-
亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式___。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有___和___。
(3)黄血盐中N原子的杂化方式为____;C、N、O的第一电离能由大到小的排序为___,电负性由大到小的排序为___。
-
某电池的工作原理如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
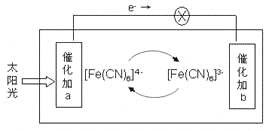
A. K+移向催化剂b
B. 催化剂a表面发生的化学反应:[Fe(CN)6]4- - e- = [Fe(CN)6]3-
C. [Fe(CN)6]3-在催化剂b表面被氧化
D. 电解质溶液中的[Fe(CN6)]4-和[Fe(CN6)]3-浓度基本保持不变
-
一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
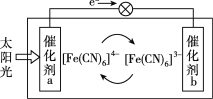
A. K+移向催化剂b
B. 催化剂a表面发生的化学反应:[Fe(CN)6]4--e-===[Fe(CN)6]3-
C. [Fe(CN)6]3-在催化剂b表面被氧化
D. 电解质溶液中的[Fe(CN)6]4-和[Fe(CN)6]3-浓度基本保持不变
-
铁铝化合物在生活生产中有广泛应用。
(1)自然界中存在的54Fe和56Fe,它们互称为_____。
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因_____。
(3)已知明矾可以净水,明矾化学式_____,试结合离子反应方程式与文字解释明矾净水的原因_____
(4)以NaAlO2溶液、AlCl3溶液、氨水、CO2气体为原料,选择合适试剂,写出实验室制备Al(OH)3的离 子方程式:(任意两条途径)_____、_____
(5)达喜是常用的中和胃酸的药物,其化学成分是铝和镁的碱式盐,化学式为Al2Mg6(OH)16CO3·4H2O【可看做2Al(OH)3·5Mg(OH)2·MgCO3·4H2O】。1mol达喜分别与足量的盐酸和 NaOH 溶液反应,消耗盐酸和 NaOH 的物质的量之比为_____。
-
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)如图是自来水表的常见安装方式,发生腐蚀过程中,电流从___(填“接头流向水表”或“水表流向接头”)。

(2)某二次电池放电的电池反应为2Fe+O2+2H2O=2Fe(OH)2。反应结束时,电池的负极的质量___(“减小”“不变”或“增加”),该电池的正极反应式为___。
(3)有如图装置:
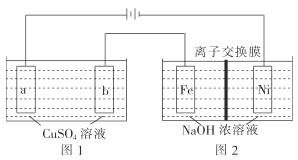
①图1中,用惰性电极电解过程中的实验数据如图,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中图1装置中产生气体的总体积(标准状况)。电解过程中转移n(e-)=0.4mol,b电极的实验现象为___;Q点时,a电极收集到的气体体积为___。

②图2中,装置通电后,溶液仍然保持澄清,铁电极附近呈紫红色(已知FeO42-在水溶液中呈紫红色),Fe电极上发生的电极反应式为___。










