-
化学与生活密切相关,下列有关说法错误的是
A. 硅胶可用作袋装食品的干燥剂
B. 液化石油气与天然气主要成分相同
C. 煤属于一次能源,电力属于二次能源
D. 甲醛是室内空气污染的主要污染物之一
难度: 简单查看答案及解析
-
下列反应的离子方程式不正确的是
A. 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B. 向NaHCO3溶液中加入稀HCl:HCO3-+H+=CO2↑+H2O
C. 向AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
难度: 中等查看答案及解析
-
常温下,在下列溶液中一定能大量共存的离子组是
A. 含有0.1mol·L-1Fe2+的溶液:Na+、ClO-、SO42-、Cl-
B. 滴加石蕊试剂呈红色的溶液:Na+、Al3+、SO42-、Cl-
C. 无色透明溶液:MnO4-、SO42-、K+、NO3-
D. 水电离产生的c(H+)=1×10-13mol·L-1的溶液:CO32-、NH4+、CI-、Ca2+
难度: 中等查看答案及解析
-
下列关于化学反应方向的说法正确的是
A. 凡是放热反应都是自发反应 B. 凡是熵增大的反应都是自发反应
C. 凡是吸热反应都不是自发反应 D. 反应是否自发,不只与反应热有关
难度: 简单查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期元素。X的氢化物常用于刻蚀玻璃,Y在同周期中金属性最强,Z的单质是人类将太阳能转化为电能的常用材料,W与X同主族。下列说法正确的是
A. 简单氢化物沸点:X>W
B. 简单离子半径:r(X)<r(Y)<r(W)
C. Z元素化学性质稳定,在自然界以游离态存在
D. W的简单离子会影响水的电离平衡
难度: 中等查看答案及解析
-
对水的电离平衡没有影响的物质是
A. 硝酸铵 B. 硫化钠 C. 氯化氢 D. 碘化钠
难度: 简单查看答案及解析
-
工业合成氨的反应为N2(g)+3H2(g)
2NH3(g),已知下列化学键的键能:
化学键
键能kJ/mol
H-H
436
N-H
391
N
N
946
下列说法正确的是
A. 该反应为吸热反应 B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1 D. 生成1 mol NH3放出92 kJ热量
难度: 中等查看答案及解析
-
实验是化学研究的基础,下图关于各实验装置(夹持装置已略去)的叙述,正确的是( )
A.
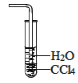 吸收HCl气体,并防止倒吸
吸收HCl气体,并防止倒吸B.
准确量取一定体积K2Cr2O7标准溶液
C.
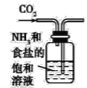 制备碳酸氢钠
制备碳酸氢钠D.
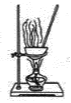 蒸干FeCl3溶液制备无水FeC13
蒸干FeCl3溶液制备无水FeC13难度: 中等查看答案及解析
-
最近全球多个国家爆发大规模流感,中药良好的预防和治疗作用再次进入科学家的视野。食用香料肉桂具有良好的预防作用,其有效成分之一肉桂酸结构简式如图所示。下列说法不正确的是
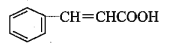
A.肉桂酸的化学式为C9H8O2
B.肉桂酸能发生加成反应、取代反应
C.肉桂酸的结构中含有4个碳碳双键
D.肉桂酸能使溴水、酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
邻甲基苯甲酸(
)有多种同分异构体,其中属于酯,且分子结构中含有甲基和苯环的同分异构体有( )
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.增大反应物浓度可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数
D.催化剂能增大单位体积内活化分子的百分数,使平衡转化率增大
难度: 中等查看答案及解析
-
在2A+B
3C+5D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
难度: 简单查看答案及解析
-
一定量的Fe与过量稀硫酸反应制取氢气,一定温度下为减慢反应速率而又不影响氢气的量,可向其中加入( )
A.CH3COOK固体 B.Zn粉 C.CuSO4晶体 D.SO3固体
难度: 简单查看答案及解析
-
常温常压下,反应N2(g)+3H2(g)⇌ 2NH3(g)的反应热和化学平衡常数分别为△H和K,则相同温度和压强下,反应4NH3(g)⇌2N2(g)+6H2(g)的反应热和化学平衡常数为( )
A.-2ΔH和 K-2 B.-2ΔH和 K2 C.2ΔH和2K D.2ΔH和K-2
难度: 简单查看答案及解析
-
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的PH=7
C.混合溶液中,c(H+)=
mol.L-1
D.混合溶液中c(H+)+c(B+)=c(OH-)+C(A-)
难度: 中等查看答案及解析
-
在一个绝热定容的密闭容器中,1molA 与 2molB 发生反应 A(g)+2B(g)
xC(g)+2D(g) △H=bkJ·mol−1(b<0),下列说法正确的是
A. 充分反应后,放出热量为 b kJ
B. 若 x=1,容器中压强不变时不能判断反应达到平衡
C. 当 B 和 D 的物质的量为 1:1 时,表明该反应已达到平衡
D. 达到平衡过程中,正反应速率可能是先增大再减小
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成n mol NO的同时,消耗n mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v逆(H2O)
难度: 中等查看答案及解析
-
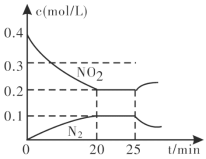
T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示,则下列结论正确的是
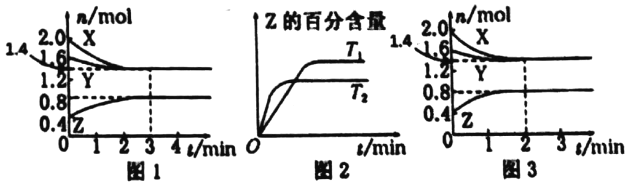
A. 容器中发生的反应可表示为3X(g)+Y(g)
2Z(g)
B. 反应进行的前3min内,用X表示的反应速率v(X)=0.2 mol·L-1·min-1
C. 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D. 保持其他条件不变,升高溫度,反应的化学平衡常数K增大
难度: 中等查看答案及解析
-
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g) ΔH=-QkJ·mol−1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
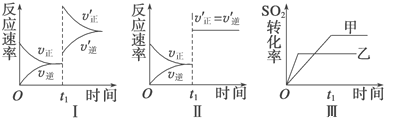
A. 图Ⅰ研究的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ研究的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
难度: 中等查看答案及解析
-
在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
难度: 简单查看答案及解析
-
常温下,下列说法正确的是
A.稀释酸溶液,溶液中所有离子的浓度均减小
B.用CH3COOH溶液做导电性实验,灯泡很暗,说明CH3COOH是弱电解质
C.相同物质的量浓度的盐酸与醋酸分别稀释相同倍数,稀释后溶液pH:盐酸<醋酸
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合,混合液呈碱性
难度: 中等查看答案及解析
-
下列说法正确的是
A. 向
溶液中逐滴加入
溶液至刚好沉淀完全,反应的离子方程式为
B. 25℃时,加水稀释
,溶液中
不断增大
C. 用浓盐酸分别和
、
反应制备
氯气,转移的电子数均为
(
为阿伏加德罗常数的值)
D. 相同物质的量浓度的下列溶液中,①
、②
、③
、④
其
由大到小的顺序是:①>②>③>④
难度: 中等查看答案及解析
-
在一定条件下,Na2CO3溶液中存在
+H2O
+OH-平衡。下列说法不正确的是( )
A.加入NaOH固体,
减小
B.通入CO2,溶液pH减小
C.升高温度,平衡常数增大
D.稀释溶液,
增大
难度: 中等查看答案及解析
-
室温下,用0.100mol•L﹣1 NaOH溶液分别滴定20.00mL 0.100mol•L﹣1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )
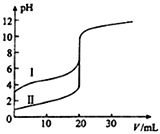
A.Ⅱ表示的是滴定醋酸的曲线
B.V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
C.pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
D.V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
难度: 中等查看答案及解析
-
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g) ⇌nY(g);ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
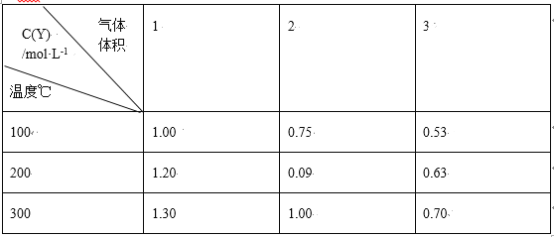
下列说法正确的是
A.m>n B.Q<0
C.温度不变,压强增大,Y的质量分数减少 D.体积不变,温度升高,平衡向逆反应方向移动
难度: 中等查看答案及解析
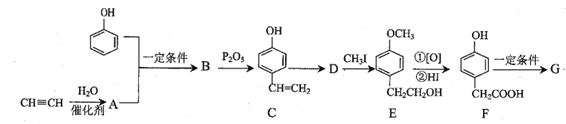
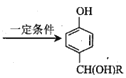 ;
;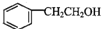 为原料(其他无机试剂任选)制备化合物
为原料(其他无机试剂任选)制备化合物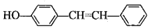 的合成路线。__。
的合成路线。__。