-
大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g)  H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g)  2CO2(g) ΔH=−566.0 kJ·mol−1
2CO2(g) ΔH=−566.0 kJ·mol−1
②N2(g)+O2(g)  2NO(g) ΔH=+180.0 kJ·mol−1
2NO(g) ΔH=+180.0 kJ·mol−1
③2NO(g)+O2(g)  2NO2(g) ΔH=−116.5 kJ·mol−1
2NO2(g) ΔH=−116.5 kJ·mol−1
回答下列问题:
①CO的燃烧热为 _________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为 ____________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A.2υ正(NO2)=υ逆(N2)
B. 混合气体的平均相对分子质量保持不变
C.气体总压强不再变化
D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___mol⋅L−1⋅min−1。
③25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。

A.缩小容器体积
B.增加NO2的浓度
C.降低温度
D.升高温度
-
大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g)  H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g)  2CO2(g) ΔH=−566.0 kJ·mol−1
2CO2(g) ΔH=−566.0 kJ·mol−1
②N2(g)+O2(g)  2NO(g) ΔH=+180.0 kJ·mol−1
2NO(g) ΔH=+180.0 kJ·mol−1
③2NO(g)+O2(g)  2NO2(g) ΔH=−116.5 kJ·mol−1
2NO2(g) ΔH=−116.5 kJ·mol−1
回答下列问题:
①CO的燃烧热为 _________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为 ____________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A.2υ正(NO2)=υ逆(N2)
B. 混合气体的平均相对分子质量保持不变
C.气体总压强不再变化
D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___mol⋅L−1⋅min−1。
③25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
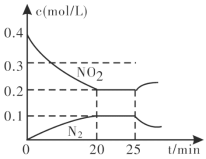
A.缩小容器体积
B.增加NO2的浓度
C.降低温度
D.升高温度
-
大气污染越来越成为人们关注的问题,烟气中的 NOx 必须脱除(即脱硝)后才能排放。
(1)已知:CH4(g)+2O2 (g)===CO2(g)+2H2O(1) ΔH=-890.3 kJ·mol-1;N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1;CH4 可用于脱硝,其热化学方程式为:CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(1),ΔH=_____。
(2)C2H4 也可用于烟气脱硝。为研究温度、催化剂中 Cu2+负载量对 NO 去除率的影响,控制其它条件一定,实验结果如图 所示。为达到最高的 NO 去除率,应选择的反应温度和 Cu2+负 载量分别是_____。

(3)臭氧也可用于烟气脱硝。一种臭氧发生装置原理如图 所示。阳极(惰性电极)的电极反应 式为_____。
(4) NO 直接催化分解(生成 N2 与 O2)也是一种脱硝途径。在不同条件下, NO 的分解产物不同。在高压下,NO 在 40 ℃下分解生成两种化合物, 体系中各组分物质的量随时间变化曲线如图 所示。写出 Y 和 Z 的化 学式: _____。

-
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式 。增加压强,NO的转化率 (填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐 (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率 脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是 。
-
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化碳( )排放量减少8%,氮氧化物(
)排放量减少8%,氮氧化物( )排放量减少10%。目前,消除大气污染有多种方法,利用钠碱循环法可脱除烟气中的
)排放量减少10%。目前,消除大气污染有多种方法,利用钠碱循环法可脱除烟气中的 。
。
(1)在钠碱循环法中,  溶液作为吸收液,可由NaOH溶液吸收
溶液作为吸收液,可由NaOH溶液吸收 制得,该反应的离子方程式是_______________________。
制得,该反应的离子方程式是_______________________。
(2)吸收液吸收 的过程中,pH随
的过程中,pH随 变化关系如下表:
变化关系如下表:
| 
| 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断 溶液显______________性,用化学平衡原理解释:_____________。
溶液显______________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):___________。
a. 
b. 
c. 
(3)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
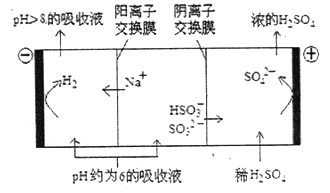
① 在阳极放电的电极反应式是________________。
在阳极放电的电极反应式是________________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
_________________。
-
环境污染问题越来越受到人们的关注,造成环境污染的主要原因是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A.温室效应——CO2 B.光化学污染——NO2
C.酸雨——SO2 D.臭氧层破坏——CO
-
随着大气污染的日趋严重,我国提出于“十二五”期间,將二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)煤燃烧排放的烟气含有SO2和NOx形成酸雨、污染大气。采用NaClO和Ca(ClO)2的混合溶液作为吸收剂可得到较好的烟气脱硫效果,已知下列反应:
SO2(g)+2OH−(aq)===SO32−(aq)+H2O(l) ΔH1
ClO−(aq)+SO32−(aq)===SO42−(aq)+Cl−(aq) ΔH2
CaSO4(s)===Ca2+(aq)+SO42−(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO−(aq)+2OH−(aq)===CaSO4(s)+H2O(l)+Cl−(aq)的ΔH=_______。
(2)在“十二五”期间重庆市也积极展开了主城区各工厂燃料“媒改气”的整改行动。“煤改气中“气”的主要成分为:____(填化学式), 其空间结构为_____(填名称),它与C3H8互称为________。
(3)甲醇(CH3OH)是一种液态可再生能源,具有开发和应用的广阔前景,在25℃、101KPa下, 1g甲醇完全燃烧放热22.68kJ,表示甲醇燃烧热的热化学方程式________。该反应在低温下___(填“自发”、“不自发”)。
-
烟气中含有大量氮氧化物NOx,工业脱硝技术成为研究热点。
(1)汽车尾气中NO和CO可利用车载催化剂转化为无毒物质排放。
已知:N2(g)+O2(g)=2NO(g) △H1=+183 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-565 kJ·mol-1
写出催化转化的热化学方程式_________。
(2)臭氧氧化-碱吸收法可有效脱除NO,氧化原理为:NO(g)+O3(g) NO2(g)+O2(g) △H=-200.9 kJ·mol-1。在容积为2L的密闭容器中充入含1.0 mol NO的模拟烟气和2.0 mol O3,在不同温度,经过相同时间(10min)NO的转化率如图所示。
NO2(g)+O2(g) △H=-200.9 kJ·mol-1。在容积为2L的密闭容器中充入含1.0 mol NO的模拟烟气和2.0 mol O3,在不同温度,经过相同时间(10min)NO的转化率如图所示。
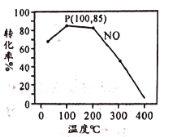
①100℃时,从开始反应到P点的平均反应速率v(NO)=__________。
②反应时同时发生副反应:2O3 3O2,共有15%的O3自身分解为O2。则P点时O3的物质的量为________mol。
3O2,共有15%的O3自身分解为O2。则P点时O3的物质的量为________mol。
(3)选择性催化还原技术(NCR)可在较低温度下脱硝,原理如图I,天然锰矿可作催化剂。
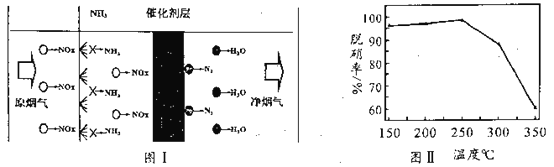
以NO代表氮氧化物,写出反应方程式_____________________;实验测得脱硝率随温度的变化如图II所示,请分析温度高于250℃时脱硝率下降的原因可能是______________。
-
烟气中含有大量氮氧化物NOx,工业脱硝技术成为研究热点。
(1)汽车尾气中NO和CO可利用车载催化剂转化为无毒物质排放。
已知:N2(g)+O2(g)=2NO(g) △H1=+183 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-565 kJ·mol-1
写出催化转化的热化学方程式_________。
(2)臭氧氧化-碱吸收法可有效脱除NO,氧化原理为:NO(g)+O3(g) NO2(g)+O2(g) △H=-200.9 kJ·mol-1。在容积为2L的密闭容器中充入含1.0 mol NO的模拟烟气和2.0 mol O3,在不同温度,经过相同时间(10min)NO的转化率如图所示。
NO2(g)+O2(g) △H=-200.9 kJ·mol-1。在容积为2L的密闭容器中充入含1.0 mol NO的模拟烟气和2.0 mol O3,在不同温度,经过相同时间(10min)NO的转化率如图所示。
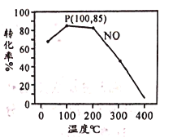
①100℃时,从开始反应到P点的平均反应速率v(NO)=__________。
②反应时同时发生副反应:2O3 3O2,共有15%的O3自身分解为O2。则P点时O3的物质的量为________mol。
3O2,共有15%的O3自身分解为O2。则P点时O3的物质的量为________mol。
(3)选择性催化还原技术(NCR)可在较低温度下脱硝,原理如图I,天然锰矿可作催化剂。
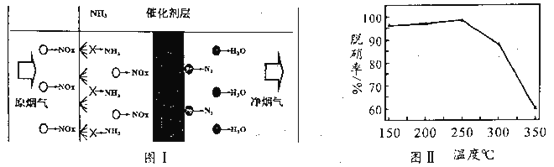
以NO代表氮氧化物,写出反应方程式_____________________;实验测得脱硝率随温度的变化如图II所示,请分析温度高于250℃时脱硝率下降的原因可能是______________。
-
甲醇是一种重要的化工原料,在化工领域有广泛应用。
(1)甲醇燃料电池由于结构简单、能量转化率高、对环境天污染,可作为常规能源的替代品而越来越受到关注。其工作原理如如图所示:
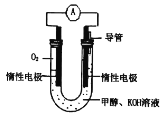
①该电池正极的电极反应为___,放电过程中负极区域溶液的pH值___(填“变大”或“变小”或“不变”)。
②该电池总反应的化学方程式为___。
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高校、光谱、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
①如图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为____。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为___mol。
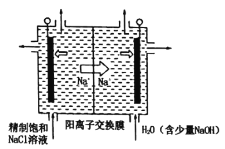
(3)英国《自然》杂志近期报道了一种新型铝离子电池,以金属铝和石墨为电极,用A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。
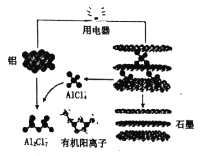
①电池放电时负极的电极反应式为___。
②充电时有机阳离子向___电极移动(填“铝”或“石墨”)。
③电池充电时,电路中每转移0.15mol电子,理论上生成___g铝。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
2CO2(g) ΔH=−566.0 kJ·mol−1
2NO(g) ΔH=+180.0 kJ·mol−1
2NO2(g) ΔH=−116.5 kJ·mol−1












