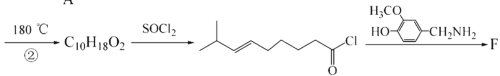
-
化学与生产、生活密切相关。下列叙述中错误的是
A.成语“蜡炬成灰”中涉及了氧化还原反应
B.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
C.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
D.采煤工业上,爆破时把干冰和炸药放在一起,既能增强爆炸威力,又能防止火灾
难度: 简单查看答案及解析
-
为阿伏加德罗常数的值,下列有关说法正确的是
A.
的溶液中:
、NH
、Cu2+、
一定能大量共存
B.标准状况下,
和
的混合气体中含有的分子总数为
C.从外观上无法区分
溶液和
胶体
D.常温下,由水电离出的
的溶液中:
、
、NO
、
可能大量共存
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A.
的同分异构体中,能与
反应生成
的有4种
B.
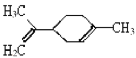 该有机物分子中所有碳原子可能在同一平面上
该有机物分子中所有碳原子可能在同一平面上C.淀粉、纤维素、塑料和氨基酸均属于天然高分子化合物
D.糖类、油脂、蛋白质都是电解质
难度: 中等查看答案及解析
-
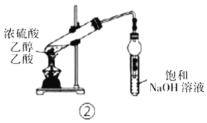
下列各实验装置的叙述中,能达到相应实验目的的是
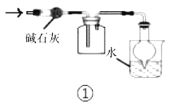
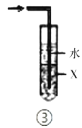
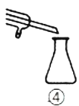
A.装置①可用于干燥、收集
,并吸收多余的
B.利用装置②及药品可制得较多的乙酸乙酯
C.装置③中X若为
,可用于吸收
或
,并防止倒吸
D.装置④用于蒸馏时的接收装置
难度: 中等查看答案及解析
-
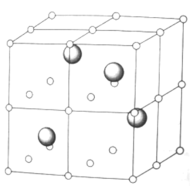
短周期主族元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们中的两种或三种元素间形成的化合物,Y元素的焰色反应呈黄色,Y、Z、Q的最高价氧化物对应水化物相互之间可反应。B是两性氢氧化物;D是由W与Q形成的化合物,常温下,
溶液的pH为1。在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是
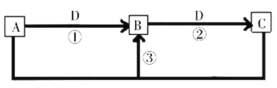
A.可通过电解熔融的C得到Z单质
B.X元素的氢化物沸点比同主族元素的氢化物高
C.W、X、Y、Z元素的原子半径大小为
D.A的水溶液呈弱碱性,是因为含有元素Y
难度: 中等查看答案及解析
-
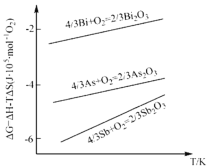
以熔融
和
为电解质,天然气经重整催化作用提供反应气的燃料电池如图。下列说法正确的是
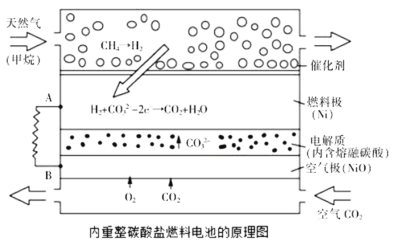
A.当外电路中通过
电子时,将消耗
B.通天然气的电极为负极,发生还原反应
C.该电池使用过程中需补充
和
D.以此电池为电源电解精炼铜,当有
转移时,有
铜析出
难度: 中等查看答案及解析
-
25℃时,向
二元酸
溶液中滴加
溶液,有关微粒物质的量变化如图。下列叙述正确的是
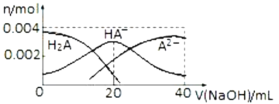
A.等体积等浓度的
溶液与
溶液混合后,其溶液中水的电离程度比纯水中的大
B.
时,溶液中存在:
C.当
时,升高温度,
减小
D.当
时,溶液中各离子浓度的大小顺序为:
难度: 中等查看答案及解析