-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.在7.8gNa2O2固体中,含有阴、阳离子的总数为0.3NA
B.光照下,将16gCH4和71gCl2组成的混合气体充分反应,生成CH3Cl分子数为NA
C.若发生水解的Fe3+为1mol,此时生成的氢氧化铁胶粒数为NA
D.100g质量分数为46%的乙醇水溶液中,所含氢原子总数为6NA
难度: 中等查看答案及解析
-
A、B、 C、D是原子序数依次增大的五种短周期主族元素。B、C、E最外层电子数之和为11;A 原子核外最外层电子数是次外层的2倍;C是同周期中原子半径最大的元素;工业上一般通过电解氧化物的方法制备D的单质;E单质是制备太阳能电池的重要材料。下列说法正确的是( )
A.简单离子半径:B>C
B.最高价氧化物对应水化物的酸性: A<E
C.工业上不用电解氯化物的方法制备单质D是由于其氯化物的熔点高
D.相同质量的C和D单质分别与足量稀盐酸反应,前者生成的氢气多
难度: 中等查看答案及解析
-
根据表中信息,判断下列叙述中正确的是
序号
氧化剂
还原剂
其他反应物
氧化产物
还原产物
①
Cl2
FeBr2
Cl﹣
②
KMnO4
H2O2
H2SO4
O2
Mn2+
③
KClO3
浓盐酸
Cl2
A.表中①组反应可能有一种或两种元素被氧化
B.表中②组反应的离子方程式是2 MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O
C.表中③组反应的还原产物是KCl,电子转移数目是6e﹣
D.氧化性强弱比较:KClO3>Fe3+>Cl2>Br2
难度: 中等查看答案及解析
-
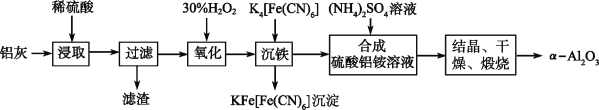
某化学兴趣小组进行了有关Cu、稀硝酸、稀硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是
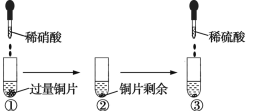
A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明HNO3被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸的强
C. 实验③发生反应的化学方程式为3Cu+Cu(NO3)2+4H2SO4
4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,又可以和稀硫酸反应
难度: 中等查看答案及解析
-
天然维生素P(结构为
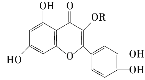 )存在于槐树花蕊中,这是一种营养增补剂。关于维生素P的叙述错误的是 ( )
)存在于槐树花蕊中,这是一种营养增补剂。关于维生素P的叙述错误的是 ( )A.可以和溴水反应
B.要用有机溶液萃取
C.分子中有三个苯环
D.1 mol维生素D可以和4 mol NaOH反应
难度: 简单查看答案及解析
-
下列实验操作、现象和结论均正确的是( )
选项
实验操作
现象
结论
A
分别向0.1mol•L﹣1醋酸和饱和硼酸溶液中滴加0.1mol•L﹣1Na2CO3溶液
醋酸中有气泡产生,硼酸中没有气泡产生
酸性:醋酸>碳酸>硼酸
B
向溶液X中滴入NaHCO3溶液
产生无色气体
X中的溶质一定是酸
C
Cl2通入品红溶液中
溶液褪色
Cl2具有漂白性
D
C2H4通入溴水中
溶液褪色
C2H4发生了还原反应
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
化学与生活、社会密切相关。下列说法不正确的是
A.我国规定商家不得无偿提供塑料袋,目的是减少“白色污染”
B.乙醇是一种易燃烧污染小的可再生能源,但只能在实验室内作燃料
C.化石燃料不可再生,使用太阳能代替化石燃料,有利于节约资源、保护环境
D.积极开发废电池的综合利用技术,防止其中的重金属盐对土壤和水源造成污染
难度: 简单查看答案及解析
-
下列图示与对应的叙述不相符的是 ( )
A.图
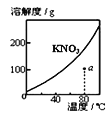 表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液B.图
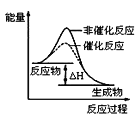 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化C.图
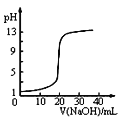 表示0.1000mol•L—1NaOH溶液滴定20.00mL0.1000mol•L—1醋酸溶液的滴定曲线
表示0.1000mol•L—1NaOH溶液滴定20.00mL0.1000mol•L—1醋酸溶液的滴定曲线D.图
 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化难度: 中等查看答案及解析
-
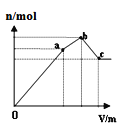
在2L密闭容器中通入a molX气体并发生反应:2X(g)
Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是
A.正反应方向为放热反应
B.在T2温度下,在0~t1时间内,v (Y) =
mol•(L•min)-1
C.M点的正反应速率v(正)大于N点的逆反应速率v(逆)
D.W点时再加入一定量X,平衡后X的转化率增大
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是

A.原子半径和离子半径均满足:Y>Z
B.氢化物的沸点不一定是:Y<R
C.最高价氧化物对应水化物的酸性:T>R
D.由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
难度: 中等查看答案及解析
-
氯仿(CHCl3)可用作麻醉剂,但常因保存不慎,而被空气中的氧气氧化,生成剧毒的光气(COCl2),发生反应的化学方程式为2CHCl3+O2→2HCl+2COCl2,为防止发生事故,在使用前要检验氯仿是否变质,应选用的试剂是( )
A.氢氧化钠溶液 B.硝酸银溶液 C.溴水 D.淀粉碘化钾试剂
难度: 简单查看答案及解析
-
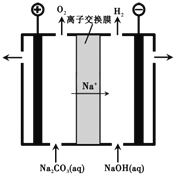
乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
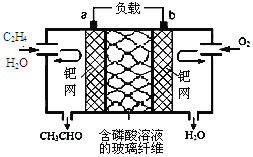
A.a电极发生还原反应
B.放电时,每转移2mol电子,理论上需要消耗28g乙烯
C.b极反应式为:O2+4e-+2H2O=4OH-
D.电子移动方向:电极a→磷酸溶液→电极b
难度: 中等查看答案及解析
-
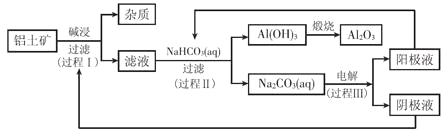
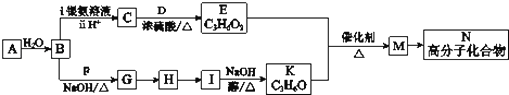
由二氧化硅制高纯硅的流程如图,下列判断中错误的是( )
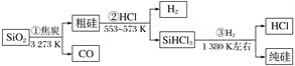
A.①②③均属于氧化还原反应 B.氢气和氯化氢均可循环利用
C.二氧化硅是一种坚硬难熔的固体 D.三氯甲硅烷(SiHCl3)摩尔质量为135.5 g
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.元素X与氢形成的原子比为1:1的化合物有很多种
B.元素W、X的氯化物中,各原子均满足8电子的稳定结构
C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素Z可与元素X形成共价化合物XZ2
难度: 简单查看答案及解析
-
将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如下图所示。.则下列说法不正确的是:
A. 镁和铝的总质量为9 g
B. 最初20 mLNaOH溶液用于中和过量的硫酸
C. 硫酸的物质的量浓度为2.5 mol·L-1
D. 生成的氢气在标准状况下的体积为11.2 L
难度: 中等查看答案及解析
-
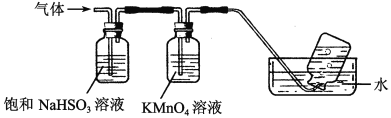
如图是产生和收集气体的实验装置,该装置适合于( )
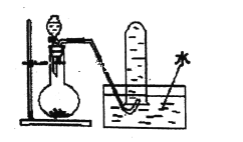
A.用浓硝酸与Cu反应制取NO2 B.用浓盐酸和MnO2反应制取Cl2
C.用H2O2溶液和MnO2反应制取O2 D.用NH4Cl和Ca (OH)2反应制取NH3
难度: 简单查看答案及解析