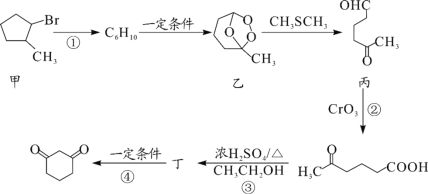
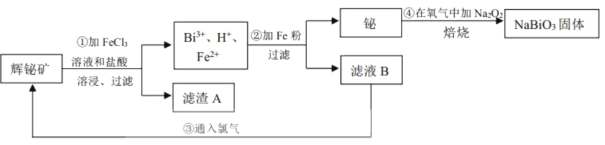
-
化学与生产、生活及社会发展密切相关,下列有关说法错误的是( )
A.“血液透析”和“静电除尘”利用了胶体的不同性质
B.燃煤中加入CaO可以减少酸雨的形成
C.从海水中提取物质都必须通过化学反应才能实现
D.在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮
难度: 简单查看答案及解析
-
阿巴卡韦(Abacavir)是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体M(
),下列说法正确的是( )
A.与环戊醇互为同系物
B.分子中所有碳原子共平面
C.能使酸性高锰酸钾溶液和溴水褪色,且反应类型相同
D.可用碳酸钠溶液鉴别乙酸和M
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.将SO2通入滴有酚酞的NaOH溶液中可检验其漂白性
B.欲除去H2S气体中混有的HCl,可将混合气体通入饱和NaHS溶液
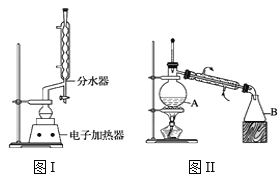
C.乙酸乙酯制备实验中,要将导管插入饱和碳酸钠溶液底部以利于充分吸收乙酸和乙醇
D.用pH试纸分别测定等物质的量浓度的NaCN和NaClO溶液的pH,可比较HCN和HClO的酸性强弱
难度: 中等查看答案及解析
-
ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
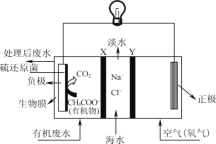
A.该装置工作时,电能转化为化学能
B.该装置可以在高温下工作
C.X为阳离子交换膜,Y为阴离子交换膜
D.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
难度: 中等查看答案及解析
-
常温下,向1L0.01mol·L-1一元酸HR溶液中逐渐通入氨气[常温下NH3·H2O电离平衡常数K=1.76×10-5],保持温度和溶液体积不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述不正确的是
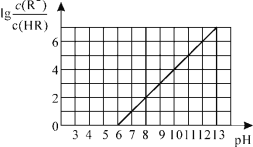
A.0.01mol·L-1HR溶液的pH约为4
B.随着氨气的通入,
逐渐减小
C.当溶液为碱性时,c(R-)>c(HR)
D.当通入0.01 mol NH3时,溶液中存在:c(R-)>c(NH4+)>c(H+)>c(OH-)
难度: 困难查看答案及解析
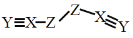
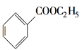 +H2O
+H2O