-
某温度下,将氯气通入NaOH溶液中,反应得到NaC1、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:4,则氯气与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
A. 21:5 B. 11:3 C. 5:1 D. 3:1
难度: 中等查看答案及解析
-
化工厂常用浓氨水检验管道是否漏氯气,其反应为:3 Cl2 + 8 NH3 ═ 6 NH4Cl +N2当有160.5 g NH4Cl产生时,被氧化的氨是
A. 214 g B. 53.5 g C. 17 g D. 68 g
难度: 中等查看答案及解析
-
下列离子方程式中,不正确的是
A. 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+=Cu2++2H2O
B. 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C. 氯化钡溶液与硫酸反应:Ba2++SO42- =BaSO4↓
D. 氧化铜与硫酸反应:CuO+2H+=Cu2++H2O
难度: 简单查看答案及解析
-
下列实验能达到目的的是
A.加热除去Na2CO3固体中的NaHCO3
B.用NaOH溶液除去CO2中的SO2气体
C.用氯水除去Fe2(SO4)3溶液中的少量FeSO4
D.用BaCl2溶液除去NaCl溶液中的K2SO4
难度: 简单查看答案及解析
-
将5mol·L-1盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度是( )
A. 0.05mol·L-1 B. 0.25mol·L-1 C. 0.1mol·L-1 D. 0.5mol·L-1
难度: 中等查看答案及解析
-
NaNO2像食盐一样有咸味,有很强的毒性,误食亚硝酸钠(NaNO2)会使人中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O。下列说法正确的是( )
A.该反应的氧化剂为HI
B.反应产物中能使淀粉变蓝的物质有I2、NaI
C.该反应中氧化剂与还原剂物质的量之比为1:1
D.人误食亚硝酸钠中毒时,可以服用HI溶液解毒
难度: 中等查看答案及解析
-
某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是
A.一定有Fe2+,一定没有Fe3+、Mg2+
B.一定有Fe3+,一定没有Fe2+、Mg2+
C.一定有Fe3+,可能有Fe2+,一定没有Mg2+
D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
难度: 中等查看答案及解析
-
下列常见物质的俗名或主要成份与化学式相对应的是( )
A.苏打——NaHCO3 B.生石灰 Ca(OH)2
C.漂白粉——Ca(ClO)2和CaCl2 D.纯碱——NaOH
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A.1 L水中溶解了40.0gNaOH,该溶液的物质的量浓度为1mol/L
B.120mL2mol·L-1KCl溶液与60mL1mol·L-1 MgCl2溶液中c(Cl-)相等
C.从1L2mol/L的盐酸溶液中取出0.5L,取出得该溶液得浓度为1mol/L
D.配制500mL0.5mol/L的CuSO4溶液,需40.0g胆矾
难度: 简单查看答案及解析
-
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,撒盐可以起到凝血作用,其化学原理是( )
A.丁达尔效应 B.胶体聚沉
C.发生复分解反应 D.发生氧化还原反应
难度: 简单查看答案及解析
-
从下列实验事实得出的结论中,不正确的是( )
选项
实验事实
结论
A
SiO2既可与NaOH溶液反应又可与HF溶液反应
SiO2为两性氧化物
B
将CO2通入Na2SiO3溶液中产生胶状沉淀H2SiO3
碳酸酸性比H2SiO3强
C
一小块钠投入水中,迅速熔成银白色小球
反应放热且钠熔点低
D
某溶液中加入浓NaOH溶液加热,产生使湿润红色石蕊试纸变蓝的气体
原溶液中含NH4+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
化学与生活密切相关,下列说法不正确的是( )
A.中国天眼传输信息用的光纤材料是二氧化硅
B.人们常利用碘化银实现人工降雨
C.港珠澳大桥用到的合金材料,具有熔点高、强度大、密度大等性能
D.华为最新一代旗舰芯片麒麟9905G中半导体材料为硅
难度: 简单查看答案及解析
-
下列关于物质分类的说法正确的是
A.Na2O、MgO、Al2O3均属于碱性氧化物
B.根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸、三元酸等
C.纯碱、熟石灰、醋酸、食盐水均为电解质
D.镁铝合金、漂白粉、水玻璃、王水均为混合物
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.Fe在氯气中燃烧生成FeCl2
B.将AlCl3溶液逐滴滴入到NaOH溶液,先产生白色沉淀,最后沉淀消失
C.电解氯化铝溶液制取金属单质铝
D.常温下,铝制品用浓硫酸或浓硝酸处理过,可耐腐蚀
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.质量数为37的氯原子:
Cl
B.硫原子的结构示意图:
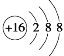
C.氮化镁的化学式:Mg2N3
D.H2CO3的电离方程式:H2CO3=2H++CO32-
难度: 中等查看答案及解析
-
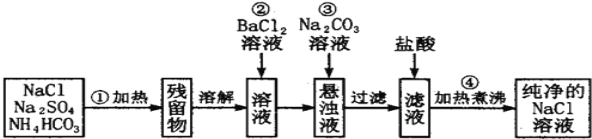
下列关于物质制备原理错误的是
A.工业制备金属钠:2NaCl
2Na+Cl2↑
B.工业生产铁:Fe2O3+3CO
2Fe+3CO2
C.湿法炼铜:Fe+CuSO4=Cu+FeSO4
D.以S为原料,工业生产硫酸在沸腾炉中的反应:2S+3O2⇌2SO3
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2L酒精中含有分子的数目为0.5NA
B.常温常压下,3.2g18O2的中子数目为2NA
C.常温常压下,24g镁与足量盐酸充分反应,转移的电子数为2NA
D.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
难度: 中等查看答案及解析
-
垃圾分类有利于资源回收利用,下列垃圾归类不正确的是( )
A
B
C
D
垃圾
废易拉罐
果皮
废旧电池
废塑料瓶
垃圾分类

可回收物

厨余垃圾

有害垃圾

其他垃圾
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
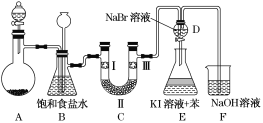
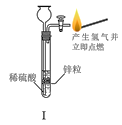
下列实验符合操作要求且能达到实验目的的是( )
A.I可用于制备氢气并检验其可燃性
B.II可用于除去CO2中的HCl
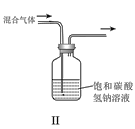
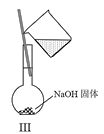
C.Ⅲ可用于配制一定物质的量浓度的NaOH溶液
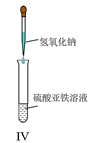
D.IV可用于制备氢氧化亚铁并长时间保存
难度: 中等查看答案及解析
-
由SiO2制备高纯度硅的工业流程如图所示:
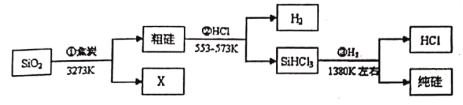
下列说法错误的是
A.SiO2与纯硅都是硬度大、熔沸点高的晶体
B.X为CO气体
C.反应②产生的H2与反应③产生的HCl可以循环使用
D.反应①②③均为在高温条件下的非氧化还原反应
难度: 中等查看答案及解析
-
向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
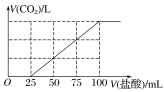
下列判断正确的是( )
A.原NaOH溶液的浓度为0.2 mol·L-1
B.通入CO2在标准状况下的体积为448 mL
C.所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D.所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
难度: 中等查看答案及解析