-
Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:
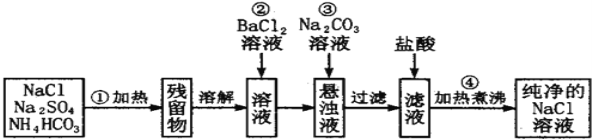
(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
-
Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:
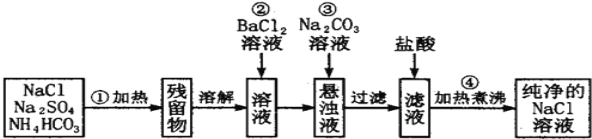
(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
-
实验室里需要纯净的溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
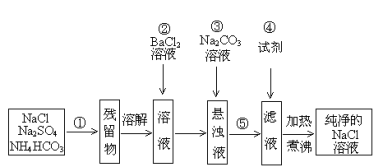
根据以上设计方案,回答下列问题:
(1)操作①和⑤的方法分别是 、 ;
(2)操作②是否可改为加硝酸钡溶液?为什么? ,(填是或否)理由: 。
(3)操作②后,如何判断SO42-已除尽,方法是 。
(4)操作③的目的是 ;
(5)操作④加的试剂是 ;发生反应的离子方程式为: 。
-
为测定碳酸氢钠纯度(含有少量氯化钠),学生设计了如下几个实验方案(每个方案均称取 m1g 样品),请回答每个方案中的问题。
(方案Ⅰ)选用重量法进行测定:可用如图中的装置进行实验。
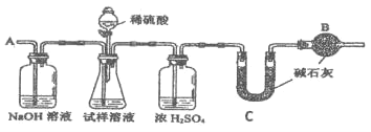
(1)A 装置中 NaOH 溶液的作用是_________;若直接向试样溶液中鼓入空气会导致实验测定结果_________(填“偏高”、“偏低”或“无影响”)。
(2)该方案需直接测定的物理量是_________。
(方案Ⅱ)选用滴定法进行测定:
(3)称取 m1g 样品,配成 100mL 溶液,取出 20mL,用 c mol/L 的标准 HCl 溶液滴定,消耗体积为 vmL, 则该试样中碳酸氢钠质量分数的计算式为:_________。
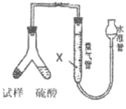
(方案Ⅲ)选用气体体积法进行测定:可用上图中的装置进行实验。
(4)为了减小实验误差,量气管中加入的液体 X为_________。
(5)通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象的原因可能是_________。
a 测定气体体积时未冷却至室温
b 测定气体体积时水准管的水面高于量气管的水面
c Y型管中留有反应生成的气体
d 气体进入量气管前未用浓硫酸干燥
(方案Ⅳ)其操作流程如下:
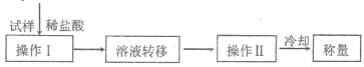
(6)操作Ⅱ的名称是_________。
(7)实验中需要的仪器有电子天平、蒸发皿、玻璃棒等,还需要的玻璃仪器是_________。
(8)在转移溶液时,如溶液转移不完全,则碳酸氢钠质量分数的测定结果_________(填“偏高”、“偏低”或“无 影响”) 。
-
为了测定氢氧化钠和碳酸钠固体混合物中碳酸钠的质量分数,甲、乙两位同学分别设计了如下的实验方案:
(I)甲同学的方案是:将mg样品溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称得固体ng。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ,甲同学洗涤沉淀的具体操作是 。
(2)Ca2+、Ba2+都可以使CO32-沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是:① ;
② 。
(Ⅱ)乙同学的方案如图所示:

(1)根据乙同学的实验装置图分析,在每次实验中,完成测定过程至少要进行 次称量操作。按照该同学的方案进行测定,结果与实际情况存在较大的误差,你认为主要原因可能是(任写两个):
① ;
② 。
(2)乙同学的方案的装置中存在一定的缺陷,请你提出改进的方法(简单叙述做法,不必画图): 。
-
某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,设计如下实验方案:
(方案1)称取一定质量的纯碱样品(已知锥形瓶和硫酸溶液的质量190.720 g),利用左图装置测定纯碱样品的纯度,每隔相同时间读得电子天平的数据如表:
| 读数次数 | 质量(g) |
| 锥形瓶+硫酸+试样 | 第1次 | 192.955 |
| 第2次 | 192.764 |
| 第3次 | 192.328 |
| 第4次 | 192.075 |
| 第5次 | 192.075 |
(1)计算纯碱样品的纯度时,必需的数据是_____________________________(填具体数据)。不必作第6次读数的原因是________________________________________________。
(2)计算纯碱样品的纯度为_________________________(保留小数后两位)。
(方案2)测定上述样品(1.15 g)中,Na2CO3质量分数的另一种方案,其操作流程如下:
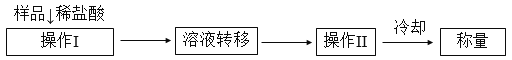
(1)溶液转移至__________(填写仪器名称),操作II的名称是______________。
(2)需直接测定的物理量是____________________。
(3)测定过程中需要的仪器有电子天平.蒸发皿、酒精灯、还需要__________、__________(固定、夹持仪器除外)。
(4)在转移溶液时,如溶液转移不完全,则Na2CO3质量分数的测定结果__________(填“偏小”、“偏大”或“不变”)
(方案3)实验装置如图:
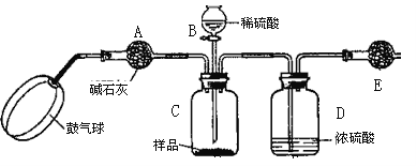
实验步骤:
①如图连接装置并加入所需药品。
②称量并记录E的质量m1(称量时注意封闭E的两端)。
③按动鼓气球,持续约1分钟。
④连接上E。
⑤打开分液漏斗B的活塞,将稀硫酸快速加入C中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录E的质量m2(称量时注意封闭E的两端及D右端的出口)。
⑧重复步骤⑥和⑦的操作,直到球形干燥管的质量基本不变,记为m3。
⑨计算。
请填空和回答问题:
(1)C中发生反应的离子方程式为:______________________________________。B仪器的名称为__________。如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果将__________(填“偏高”、“偏低”或“不变”)。
(2)浓硫酸的作用是_________________,若没有D,则实验结果__________(填“偏高”、“偏低”或“无影响”)。
(3)步骤③和⑥的作用是____________________,____________________。鼓气球的速度是快速好,还是缓慢鼓入?为什么?__________________________________________。
(4)E装置的固体试剂为__________(填编号)
A.碱石灰 B.无水氯化钙 C.浓硫酸 D.生石灰
(5)步骤⑧的目的是________________________________________________。
(6)试样中纯碱样品的质量分数计算式为_____________________________________。
(7)本实验设计中若有需要改进的地方,请指出该进之处并说明原因。
_______________________________________________________________________。
(8)实验还可以用其它定量实验方法测定试样中纯碱的质量分数,请简述一种不同的定量实验方法。___________________________________________________________ 。
-
某氯化钾样品含少量的碳酸钾、硫酸钾和不溶于水的杂质,为了提纯氯化钾,先将样品溶于适量的水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法正确的是( )
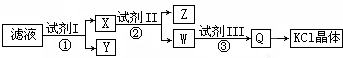
A.图示的步骤中必需要经过2次过滤操作 B.起始滤液呈中性
C.试剂II为Na2CO3溶液 D.试剂III为盐酸
-
在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量的NaOH溶液,③加适量的盐酸,④加过量的碳酸钠溶液,⑤加过量的氯化钡溶液。正确的操作顺序是
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④③①
-
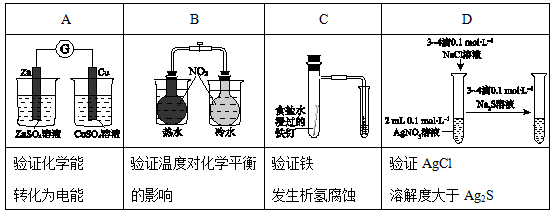
Ⅰ.下图所示的实验,能达到实验目的的是
Ⅱ在氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其溶于水后加少量盐酸配制成水溶液,然后按下图所示的操作步骤进行提纯。
已知:在pH=4~5时,Cu2+、Fe2+不水解,而Fe3+几乎完全水解而沉淀。
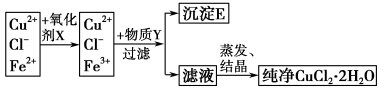
回答下列问题:
(1)下列物质都可以作为氧化剂,其中适合本实验的X是 (填字母)。
A.H2O2 B.KMnO4 C.氯水 D.K2Cr2O7
(2)写出加入氧化剂X后,发生反应的离子方程式(写一个即可) 。
(3)加入Y调节溶液的pH至4~5。物质Y可能是 (填字母)。
A.氨水 B.Cu C.Cu(OH)2 D. CuO
(4)欲将CuCl2·2H2O加热制得无水CuCl2,可在HCl气氛下蒸发,否则得不到纯净CuCl2固体。试用简要的文字和相应化学方程式解释这样操作的原因: 。
-
(12分)羟基是重要的官能团。某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。
①碳酸 ②乙醇 ⑧苯酚 ④乙酸
I. 甲同学设计并实施了如下实验方案。
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
| 1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①④溶液 | |
| 2 | 向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 | ②中无明显现象 ③中红色明显变浅 | 滴加③时反应的化学方程式: _____________________ |
| 3 | 测定CH3COOH溶液 与H2CO3溶液的酸性 | | CH3COOH溶液的酸性远大于H2CO3溶液 |
| 4 | 将CO2通入C6H5ONa溶液中 | ____________ | 反应的化学方程式: ___________________ |
| 结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号) ______ ________ |
II. 乙同学在研究了甲同学的实验方案后,提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。
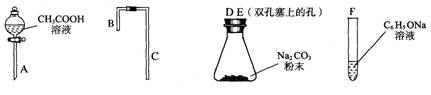
(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)_ ____中,B管插入__________中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有________溶液的洗气装置,使乙同学的实验设计更加完善。













