-
下列关于铝及其化合物说法,不正确的是( )
A.明矾可用作净水剂和消毒剂 B.利用铝热反应可冶炼高熔点金属
C.铝可用作包装材料和建筑材料 D.氢氧化铝可用作治疗胃酸过多的药物
难度: 简单查看答案及解析
-
下列有关实验的操作正确的是
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
C.为观察Mg条在CO2气体中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满 CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部。
D.用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值
难度: 中等查看答案及解析
-
下列方法(必要时可加热)不合理的是
A.用澄清石灰水鉴别CO和CO2
B.用水鉴别苯和四氯化碳
C.用Ba(OH)2溶液鉴别NH4Cl、(NH4)2SO4和K2SO4
D.用淀粉碘化钾试纸鉴别碘水和溴水
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.FeSO4常用于制取净水剂,原因是溶于水时形成具有净水作用的氢氧化亚铁胶体
B.纳米铁粉和FeS都可以去除水体中的Cu2+、Hg2+等离子,其原理不相同
C.SO2具有还原性,可用KMnO4溶液测定食品中SO2残留量
D.利用碳酸钠溶液可消除燃煤烟气中的SO2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.亚硝酸钠溶液具有防腐作用,可用来浸泡新鲜瓜果
B.我国古代就已采用加热胆矾或绿矾的方法制取硫酸
C.红宝石是含有少量金属氧化物的刚玉,主要成分为二氧化硅
D.Na3AlF6溶液中滴加lmol/L氨水至过量会产生白色沉淀
难度: 中等查看答案及解析
-
下列有关实验的说法,正确的是
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.纸层析点样所用的试剂的浓度应较小,点样时的试剂斑点直径应小于0.5cm
C.用标准HCl溶液滴定未知浓度NaHCO3溶液时可选择甲基橙为指示剂
D.在“硫酸亚铁铵的制备”实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
难度: 简单查看答案及解析
-
下列关于氮及其化合物的说法,不正确的是
A.铵盐一般都溶于水,且都可分解放出氨气
B.液氨气化时会吸收大量的热,所以NH3可用作制冷剂
C.汽车尾气中的氮氧化物是造成光化学烟雾的主要原因之一
D.工业浓硝酸通常呈黄色,是因为溶解了NO2气体
难度: 简单查看答案及解析
-
下列说法不正确的是
A.干冰可用于人工降雨 B.碘酸钾可用作加碘食盐的添加剂
C.碳酸钠是发酵粉的主要成分 D.次氯酸钙是漂白粉的有效成分
难度: 简单查看答案及解析
-
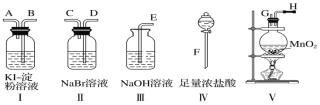
萃取碘水中的碘并分液,需要用到的仪器是( )
A.
 B.
B. C.
C.D.
难度: 简单查看答案及解析
-
化学实验操作中必须十分重视安全问题。下列处理方法错误的是
A.不慎打翻燃着的酒精灯,立即用湿抹布盖灭
B.金属钠着火时,立即用泡沫灭火器进行灭火
C.给盛有液体的试管加热时,要不断移动试管或加入碎瓷片
D.浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上3%~ 5%的硼酸溶液
难度: 中等查看答案及解析
-
下列说法不正确的是
A.二氧化硅导电能力强,可用于制造光导纤维
B.石灰石在高温下可用于消除燃煤烟气中的SO2
C.可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油
D.利用催化剂可减少汽车尾气中有害气体的排放
难度: 简单查看答案及解析
-
下列说法不正确的是
A.[Cu(NH3)4]SO4可通过CuSO4溶液与过量氨水作用得到
B.铁锈的主要成分可表示为Fe2O3·nH2O
C.钙单质可以从TiCl4中置换出Ti
D.可用H2还原MgO制备单质Mg
难度: 简单查看答案及解析
-
下列离子方程式不正确的是
A.氢氧化钠溶液与二氧化硅反应 SiO2 + 2OH-=SiO32- + H2O
B.碳酸钠溶液与氢氧化钡溶液反应 CO32-+ Ba(OH)2=BaCO3↓+2OH-
C.酸性硫酸亚铁溶液在空气中被氧化 4Fe2++O2+4H+=4Fe3++2H2O
D.氯气与氢氧化钠溶液反应 Cl2+ 2OH-=ClO- +Cl-+H2O
难度: 中等查看答案及解析
-
下列说法不正确的是
A.在硫酸工业的吸收塔中,采用浓硫酸吸收三氧化硫
B.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
C.SO2与过量氨水反应得到
D.无水CoCl2吸水会变为蓝色,可用于判断变色硅胶是否吸水
难度: 简单查看答案及解析
-
不能正确表示下列变化的离子方程式是
A.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O =2AlO
+3H2↑
C.室温下,测得小苏打溶液pH>7,证明碳酸是弱酸:HCO
+H2O
H2CO3+OH-
D.将0.10 mol·L-1 NH4Fe(SO4)2溶液与0.40 mol·L-1 NaOH溶液等体积混合:
+Fe3++4OH-=Fe(OH)3↓+NH3·H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 32 g S8(分子结构:
 )中的共价键数目为NA
)中的共价键数目为NAB. 2 g由H218O和2H2O组成的物质中含有的质子数为NA
C. 8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
难度: 中等查看答案及解析
-
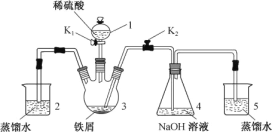
下列有关实验操作或实验原理叙述正确的是
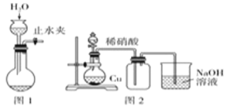
A.可以用pH试纸测定饱和氯水的pH
B.用10mL量筒量取8.5 mL 0.1 mol·L-1 盐酸
C.用图1所示操作检查装置的气密性
D.实验室用图2所示装置制取纯净的NO2
难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是
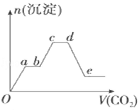
A.Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O
B.ab段与cd段所发生的反应相同
C.de段沉淀减少是由于BaCO3固体消失
D.bc段反应的离子方程式是2AlO2﹣+3H2O+CO2═2Al(OH)3↓+CO32﹣
难度: 困难查看答案及解析
-
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1∶1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产生等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与O2
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊溶液中,溶液先变蓝,后褪色
A.①③⑥⑧ B.③⑦⑧
C.②⑤⑥⑦ D.①④⑧
难度: 中等查看答案及解析
-
现有Na2SO3、Na2S04混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A.将样品配制成溶液V1L,取其中25.00 mL用标准KMn04溶液滴定,消耗标准 KMn04 溶液V2 mL
B.向样品中加足量H202,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg
C.将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g
D.将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHS03的洗气瓶、盛有浓H2S04的洗气瓶、盛有碱石灰的干燥管I、盛有碱石灰的干燥管II,测得干燥管I增重dg
难度: 困难查看答案及解析
-
足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol•L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50mL,下列说法正确的是( )
A.参加反应的硝酸是0.2mol B.消耗氧气的体积为1.68 L
C.铜和硝酸反应过程中转移的电子为0.3 mol D.混合气体中含NO21.12 L
难度: 困难查看答案及解析
-
向NaOH和Na2CO3混合溶液中滴加0.1mol•L﹣1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
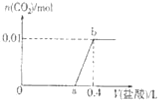
A.在0﹣a范围内,只发生中和反应
B.ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
难度: 中等查看答案及解析
-
某绿色溶液A含有H+、Na+、Mg2+、Fe2+、Cu2+、SO
、Clˉ、CO
和HCO
离子中的若干种。取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于硝酸):
①向溶液中滴加少量
溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
②取滤液B,先用HNO3酸化,再滴加0.001 mol·Lˉ1 AgNO3溶液,有白色沉淀生成。
下列说法不正确的是
A.溶液A中一定存在H+、SO
和Clˉ
B.溶液A中不存在Mg2+、CO
和HCO
,不能确定Na+的存在
C.第②步生成的白色沉淀中只有AgCl,没有Ag2CO3
D.溶液A中存在Fe2+与Cu2+中的一种或两种,且可用NaOH溶液判断
难度: 中等查看答案及解析
-
由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
烧渣
溶液
绿矾
铁黄
已知:FeS2和铁黄均难溶于水
下列说法不正确的是( )
A.步骤①,最好用硫酸来溶解烧渣
B.步骤②,涉及的离子反应为FeS2+14Fe3++8H2O=15Fe2++2SO
+16H+
C.步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D.步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
难度: 困难查看答案及解析