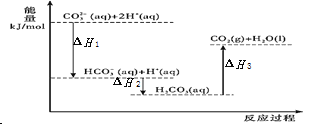-
下列叙述中,一定能判断化学平衡移动的是
A. 混合物中各组分的浓度改变
B. 正、逆反应速率改变
C. 混合物中各组分的百分含量改变
D. 混合体系的压强改变
难度: 中等查看答案及解析
-
下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
难度: 简单查看答案及解析
-
下列属于强电解质的是( )
A.碳酸钙 B.食盐水 C.氨气 D.醋酸
难度: 简单查看答案及解析
-
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是
A.
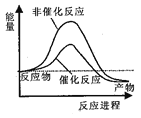 B.
B.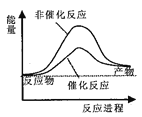
C.
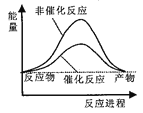 D.
D.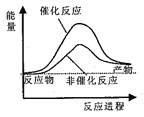
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.HCl 和 NaOH 反应的中和热 ΔH =-57.3 kJ·mol-1,则H2SO4和 Ba(OH)2反应的中和热ΔH =-114.6kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO(g)+O2(g)=2CO2(g)的 ΔH =+566.0 kJ·mol-1
C.2 mol H2O具有的能量高于2 mol H2和1 mol O2的总能量
D.1 mol 乙醇燃烧生成气态水和二氧化碳时所放出的热量是乙醇的燃烧热
难度: 中等查看答案及解析
-
下列事实与盐类水解无关的是( )
A.明矾可以净水
B.使用热的纯碱溶液去除油污效果好
C.实验室配制 FeCl2 溶液时加入少量稀盐酸
D.向 FeCl3 溶液中加入 KOH 溶液产生红褐色沉淀
难度: 中等查看答案及解析
-
反应 C(s)+H2O(g)
CO(g)+H2(g)在一个可变容积的密闭容器中进行,下列条件的改变 对其反应速率几乎无影响的是( )
①增加碳的量且表面积保持不变 ②加热③保持体积不变,充入 He,使体系压强增大 ④保持压强不变,充入 He,使容器体积变大
A.②④ B.②③ C.①④ D.①③
难度: 简单查看答案及解析
-
下列方程式书写正确的是( )
A.KHSO4在熔融状态下的电离方程式:KHSO4=K++
B.甲烷燃料电池碱性条件下的负极电极反应式:CH4-8e-+2H2O=CO2+8H+
C.S2-的水解方程式:S2-+2H2O
H2S+2OH-
D.AgCl 的沉淀溶解平衡方程式:AgCl (s)= Ag+(aq)+ Cl-(aq)
难度: 中等查看答案及解析
-
下列各组溶液混合后,溶液显碱性的是( )
A.1mL 0.1 mol·L-1NH3﹒H2 O 与 1mL 0.1 mol·L-1 HCl
B.1mL 0.1 mol·L-1K2S与1mL 0.1 mol·L-1K2SO4
C.1mL 0.1 mol·L-1KOH 与 1mL 0.1 mol·L-1KHCO3 ,再加入1 mL 0.1 mol·L-1BaCl2
D.1mL 0.1 mol·L-1NaOH 与 1mL 0.1 mol·L-1H2 SO 4
难度: 中等查看答案及解析
-
下列各组中,每种电解质溶液用惰性电极电解时只生成氢气和氧气的一组是( )
A.NaOH、H2SO4、KNO3 B.NaCl、CuSO4、H2SO4
C.HCl、CuCl2、Ba(OH)2 D.AgNO3、HI、KOH
难度: 中等查看答案及解析
-
将NO2装入带有活塞的密闭容器中,当反应2NO2(g)
N2O4(g)达到平衡后,改变某个条件,下列叙述正确的是( )
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
难度: 中等查看答案及解析
-
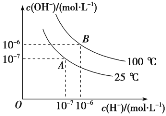
室温下向
溶液中加入
的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是
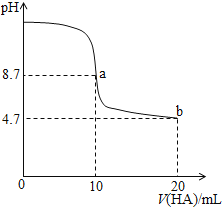
A.a点所示溶液中
B.a、b两点所示溶液中水的电离程度相同
C.
时,
D.b点所示溶液中
难度: 中等查看答案及解析
-
室温下,下列叙述正确的是( )
A.pH=2 的盐酸与 pH=12 的氨水等体积混合后 pH>7
B.pH=4的盐酸溶液,稀释至 10 倍后 pH>5
C.0.2 mol·L-1 的醋酸,与等体积水混合后 pH=1
D.100 ℃纯水的 pH=6,所以水在 100 ℃时呈酸性
难度: 中等查看答案及解析
-
在密闭容器中发生如下反应:aA(g)+bB(g)
cC(g)。其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是
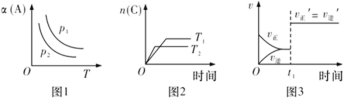
A.如图1反应:若p1>p2,则该反应只能在高温下自发进行
B.如图2反应:此反应的△H<0,且T1>T2
C.如图3反应:表示t1时刻可能是使用催化剂对反应速率的影响
D.如图3反应:表示t1时刻增大B的浓度对反应速率的影响
难度: 困难查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g)
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
难度: 简单查看答案及解析
-
在相同温度下,有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入 1 mol SO2 和 1 mol O2,乙容器中充入 2 mol SO2 和 2 mol O2。下列叙述中正确的是( )
A.平衡时 SO2 的转化率:乙<甲 B.平衡时 O2 的浓度:乙<甲
C.化学反应速率:乙<甲 D.平衡时 SO2 的体积分数:乙<甲
难度: 中等查看答案及解析
-
t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是
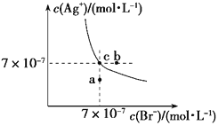
A.在t ℃时,AgBr的Ksp为4.9×10-13
B.通过蒸发,可使溶液由a点变到c点
C.图中b点有AgBr沉淀析出
D.在t ℃时,AgCl(s)+Br-(aq)
AgBr(s)+Cl-(aq)的平衡常数K≈816
难度: 中等查看答案及解析
-
化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是( )
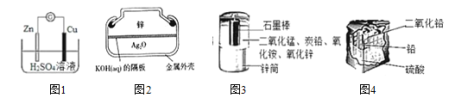
A.图 1 锌铜原电池中,Zn2+向 Cu 电极方向移动,Cu 电极附近溶液中 H+浓度增加
B.图 2 纽扣式银锌电池中,正极的电极反应式为 Ag2O+2e -+H2O = 2Ag+2OH-
C.图 3 锌锰干电池中,锌筒作负极,发生氧化反应,锌筒会变薄
D.图 4 铅蓄电池中,使用一段时间后,电解质溶液的酸性减弱,导电能力下降
难度: 简单查看答案及解析
-
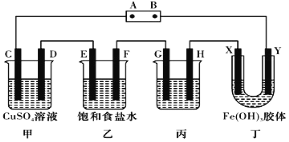
用如图装置研究电化学原理,下列分析中错误的是
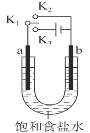
选项
连接
电极材料
分析
a
b
A
K1K2
石墨
铁
模拟铁的吸氧腐蚀
B
K1K2
锌
铁
模拟钢铁防护中牺牲阳极的阴极保护法
C
K1K3
石墨
铁
模拟电解饱和食盐水
D
K1K3
铁
石墨
模拟钢铁防护中外加电流的阴极保护法
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某微生物电池在运行时可同时实现净化有机物污水、净化含 Cr2O72-废水( pH 约为 6)和淡化食盐水,其装置示意图如图所示。图中 D 和 E 为阳离子交换膜或阴离子交换膜,Z 为 待淡化食盐水。已知 Cr3+ 完全沉淀所需的 pH 为 5.6。下列说法不正确的是

A.C室的电极反应式为
+6e+8H+=2Cr(OH)3 ↓ + H2O
B.X为有机物污水,Y为含
废水
C.理论上处理 1mol
废水的同时可脱除 6mol的NaCl
D.E为阴离子交换膜
难度: 中等查看答案及解析