-
在全国人民众志成城抗击新冠病毒期间,使用的“84消毒液”的主要有效成分是
A.NaOH B.NaCl C.NaClO D.Na2CO3
难度: 简单查看答案及解析
-
晋朝葛洪的《肘后备急方》中记载:“青蒿一握,以水二升渍,绞取汁,尽服之……”,受此启发为人类做出巨大贡献的科学家是
A.屠呦呦 B.钟南山 C.侯德榜 D.张青莲
难度: 简单查看答案及解析
-
下列说法错误的是
A.淀粉和纤维素均可水解产生葡萄糖
B.油脂的水解反应可用于生产甘油
C.氨基酸是组成蛋白质的基本结构单元
D.淀粉、纤维素和油脂均是天然高分子
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.CaCO3与稀硝酸反应:
B.FeSO4溶液与溴水反应:
C.NaOH溶液与过量H2C2O4溶液反应:
D.C6H5ONa溶液中通入少量CO2:
难度: 中等查看答案及解析
-
下列实验仪器或装置的选择正确的是
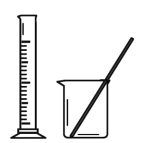
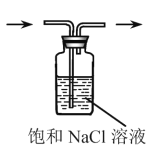
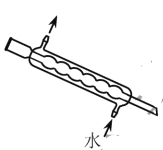
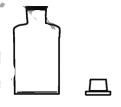
配制50.00mL0.1000mol.L-1
Na2CO3溶液
除去Cl2中的HCl
蒸馏用冷凝管
盛装Na2SiO3溶液的试剂瓶
A
B
C
D
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
检验下列物所选用的试剂正确的是
待检验物质
所用试剂
A
海水中的碘元素
淀粉溶液
B
SO2气体
澄清石灰水
C
溶液中的Cu2+
氨水
D
溶液中的
NaOH溶液,湿润的蓝色石蕊试纸
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
常温下,下列有关电解质溶液的说法错误的是
A.相同浓度的 HCOONa和NaF两溶液,前者的pH较大,则
B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则
D.在
溶液中,
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
元素
X
Y
Z
W
最高价氧化物的水化物
H3ZO4
溶液对应的pH(25℃)
1.00
13.00
1.57
0.70
A.元素电负性:Z<W B.简单离子半径:W<Y
C.元素第一电离能:Z<W D.简单氢化物的沸点:X<Z
难度: 简单查看答案及解析
-
关于
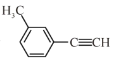 的说法正确的是
的说法正确的是A.分子中有3种杂化轨道类型的碳原子
B.分子中共平面的原子数目最多为14
C.分子中的苯环由单双键交替组成
D.与Cl2发生取代反应生成两种产物
难度: 简单查看答案及解析
-
理论研究表明,在101kPa和298K下,
异构化反应过程的能量变化如图所示。下列说法错误的是
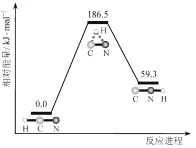
A.HCN比HNC稳定
B.该异构化反应的
C.正反应的活化能大于逆反应的活化能
D.使用催化剂,可以改变反应的反应热
难度: 简单查看答案及解析
-
熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为
(x=5~3,难溶于熔融硫),下列说法错误的是
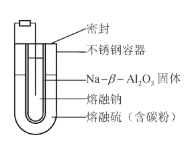
A.Na2S4的电子式为
B.放电时正极反应为
C.Na和Na2Sx分别为电池的负极和正极
D.该电池是以
为隔膜的二次电池
难度: 中等查看答案及解析
-
已知
呈粉红色,
呈蓝色,
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
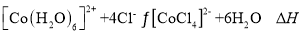 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下: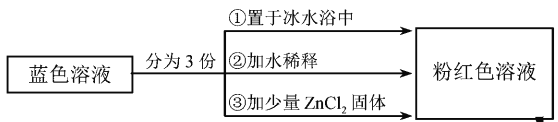
以下结论和解释正确的是
A.等物质的量的
和
中σ键数之比为3:2
B.由实验①可推知△H<0
C.实验②是由于c(H2O)增大,导致平衡逆向移动
D.由实验③可知配离子的稳定性:
难度: 困难查看答案及解析
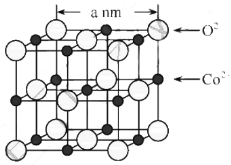
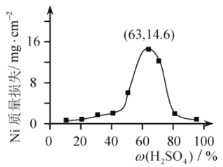
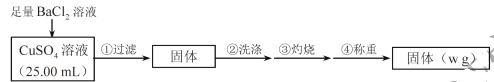
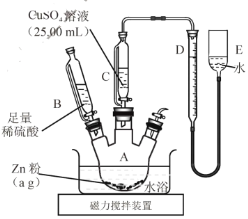
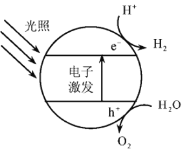
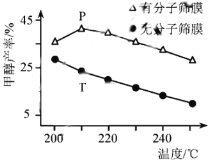
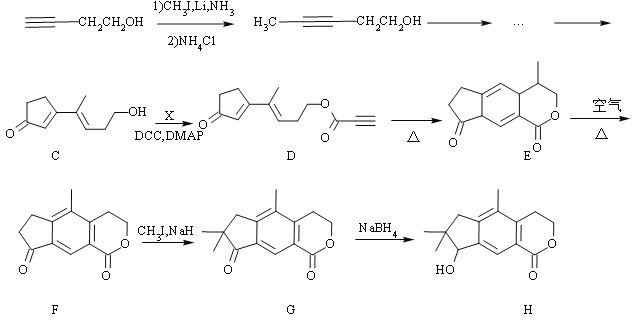
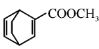 ,写出路线流程图(无机试剂和不超过2个碳的有机试剂任选)_______________。
,写出路线流程图(无机试剂和不超过2个碳的有机试剂任选)_______________。