-
下列变化需克服相同类型作用力的是
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钾的溶解 D.溴和汞的气化
难度: 中等查看答案及解析
-
按电子排布,可把周期表里的元素划分成5个区,以下元素属于p区的是( )
A.Fe B.Mg C.P D.Cu
难度: 简单查看答案及解析
-
金属晶体的形成是因为晶体中存在( )
A.金属离子间的相互作用 B.金属原子间产生相互作用
C.金属离子与自由电子间的相互作用 D.金属原子与自由电子间的相互作用
难度: 简单查看答案及解析
-
下列的晶体中,化学键种类相同,晶体类型也相同的是
A.SO2与SiO2 B.CO2与H2O C.NaCl与HCl D.CCl4与KCl
难度: 中等查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据表所列数据判断错误的是
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
580
1800
2700
11600
A.元素X的常见化合价是+1
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
难度: 中等查看答案及解析
-
下列数据是对应物质的熔点(℃),据此做出的下列判断中错误的是( )
Na2O
NaCl
AlF3
AlCl3
920
801
1 291
190
BCl3
Al2O3
干冰
SiO2
-107
2 073
-57
1 723
A.铝的化合物形成的晶体中有的是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
难度: 简单查看答案及解析
-
某元素原子的价电子排布式是3s23p4,则它在周期表中的位置是 ( )
A.第二周期第ⅣA族 B.第三周期第ⅣA族
C.第四周期第ⅡA族 D.第三周期第ⅥA族
难度: 简单查看答案及解析
-
下列化学式既能表示物质的组成,又能表示物质的一个分子的是( )
A.NaOH B.SiO2 C.Fe D.CH4
难度: 中等查看答案及解析
-
下列晶体中不属于原子晶体的是
A.干冰 B.金刚砂 C.金刚石 D.水晶
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.区分晶体和非晶体最科学可靠的方法是对固体进行X射线衍射实验
B.离子晶体中一定含金属阳离子
C.在共价化合物分子中各原子都形成8电子结构
D.分子晶体的熔点一定比金属晶体的熔点低
难度: 中等查看答案及解析
-
下列各物质中,按熔点由高到低的顺序排列正确的是( )
A.HF>HCl>HBr>HI B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li D.金刚石>晶体硅>钠
难度: 中等查看答案及解析
-
下列分子或离子中,立体构型是平面三角形的是( )
A.CH4 B.NH
C.NO
D.CO2
难度: 简单查看答案及解析
-
下列关于丙烯(CH3—CH=CH2)的说法错误的是( )
A.丙烯分子有8个σ键,1个π键 B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键 D.丙烯分子中3个碳原子在同一平面上
难度: 简单查看答案及解析
-
下列电子排布式或轨道表示式正确的是( )
①C原子的轨道表示式:
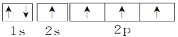
②Cr原子的电子排布式:1s22s22p63s23p63d44s2
③O原子的轨道表示式:
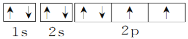
④Br原子的外层电子排布式:3d104s24p5
⑤B原子的轨道表示式:

A.① ② ③ B.② ③ ④ C.① ② ④ ⑤ D.只有③
难度: 中等查看答案及解析
-
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
X
W
Y
R
Z
A.常压下五种元素的单质中Z单质的沸点最高
B.W的氢化物的沸点比X的氢化物的沸点高
C.Y元素的非金属性比W元素的非金属性强
D.Y、Z的阴离子电子层结构都与R原子的电子层结构相同
难度: 中等查看答案及解析
-
下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随着相对分子质量的增加而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
难度: 简单查看答案及解析
-
下列关于电离能和电负性的说法不正确的是( )
A.硅的第一电离能高于碳,而电负性低于碳
B.第一电离能的大小:Mg>Al
C.F、Ne、K、Fe四种元素中电负性最大的是F
D.Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳
难度: 中等查看答案及解析
-
某晶体的晶胞结构为正三棱柱(如图所示),这种晶体中A、B、C三种微粒数目之比为( )
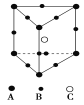
A.1∶4∶2 B.3∶9∶4
C.2∶9∶4 D.3∶8∶4
难度: 简单查看答案及解析
-
配位化合物简称配合物,它的数量巨大,组成和结构形形色色。配合物[Cu(NH3)4](OH)2的中心离子、配体、中心离子的电荷数和配位数分别为( )
A.Cu2+、 OH-、 2+、 2 B.Cu+、 NH3、 1+、 4
C.Cu2+、 NH3、 2+、 4 D.Cu2+、 NH3、 2+、 2
难度: 简单查看答案及解析
-
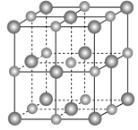
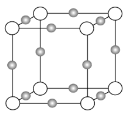
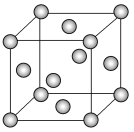
以NA表示阿伏加德罗常数的值,下列说法错误的是( )
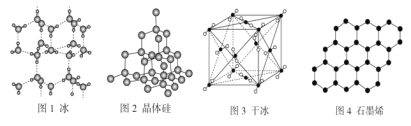
A.18 g冰(图1)中含O—H键数目为2NA
B.28 g晶体硅(图2)中含有Si—Si键数目为2NA
C.44 g干冰(图3)中含有4NA个CO2分子
D.石墨烯(图4)是碳原子单层片状新材料,12 g石墨烯中含C—C键数目为1.5NA
难度: 简单查看答案及解析