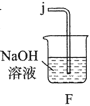
-
下列过程与“盐类的水解平衡”或“难溶电解质的溶解平衡”无关的是( )
A. 将NaOH溶液加入NaHSO4溶液中使其转化为Na2SO4
B. 将TiCl4加入水中并加热使其转化为TiO2•xH2O
C. 将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3
D. 将Na2S溶液加入含Hg2+的废水中使其转化为HgS沉淀
难度: 中等查看答案及解析
-
2020年新冠肺炎疫情在全球多点爆发。新型冠状病毒对紫外线和热敏感,56℃持续30分钟、酒精、含氯消毒剂、过氧乙酸等均可有效灭活病毒。下列有关说法正确的是( )
A.84消毒液的有效成分是
B.84消毒液与酒精混合使用可增强灭活病毒效果
C.加热能杀死病毒是因为蛋白质受热发生变性
D.聚丙烯树脂是生产无纺布口罩的初始原料之一,聚丙烯可以使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
下列叙述错误的是( )
A.乙醇、乙酸在一定条件下都可以断裂O-H键
B.乙烯水化生成乙醇属于加成反应
C.甲烷与足量氯气在光照条件下反应的生成物都难溶于水
D.乙醛与环氧乙烷(
)互为同分异构体
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是电子层数的3倍,Z的焰色反应呈黄色。常温下,Z和W形成化合物的水溶液的pH=7。下列说法正确的是( )
A.X与W属于不同周期、不同主族元素
B.简单离子半径:X<Z
C.简单氢化物的沸点:Y>W>Z
D.Z和W形成的化合物的水溶液与Y单质反应,能置换出W
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.
的
溶液中,含有0.1NA个
B.
的
中,含有0.5NA个中子
C.
在足量
中燃烧,转移的电子数为6NA
D.常温常压下,
和
的混合气体中含有的原子数为6NA
难度: 简单查看答案及解析
-
下列实验操作不能达到相应实验目的的是( )
选项
实验目的
实验操作
A
配制
溶液
先将
固体溶于较浓的盐酸中,再加蒸馏水稀释到所需要的浓度
B
比较醋酸与碳酸酸性的强弱
将
计分别伸入
溶液和
溶液,读取
C
检验溶液中是否含有
取少量试剂于试管中,加入浓
溶液并加热,用湿润的红色石蕊纸检验产生的气体
D
试清洗碘升华实验所用试管
先用酒精清洗,再用水冲洗
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
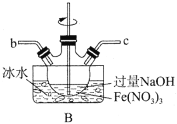
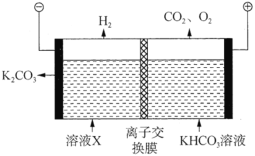
一种三电极电解水制氢的装置如图,三电极为催化电极a、催化电极b和Ni(OH)2电极。通过控制开关连接K1或K2,可交替得到H2和O2。下列说法错误的是( )
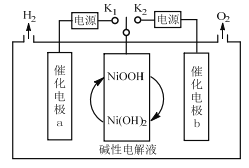
A.制O2时,电子由Ni(OH)2电极通过外电路流向催化电极b
B.制H2时,阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O
C.催化电极b上,OH-发生氧化反应生成O2
D.该装置可在无隔膜的条件下制备高纯氢气
难度: 中等查看答案及解析
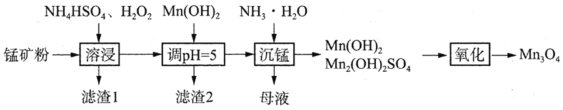
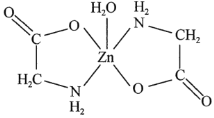
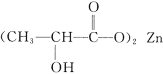 ]是一种很好的食品锌强化剂,其中存在的作用力有________(填编号)。
]是一种很好的食品锌强化剂,其中存在的作用力有________(填编号)。