-
从古到今,化学与生活、诗词文化处处相关,下列说法错误的是( )
A.唐代王维《山居秋暝》中诗句“空山新雨后,天气晚来秋”里描述了下雨时由于氧气在放电条件下发生氧化还原反应生成少量臭氧,故有雨后天气清新的现象
B.唐代白居易《钱塘湖春行》中诗句“几处早莺争暖树,谁家新燕啄春泥”里的泥土含多种元素,大多数以硅酸盐的形式存在
C.宋代辛弃疾词句“醉里挑灯看剑,梦回吹角连营”里的宝剑是由铁、碳、铬等组分的合金制成的
D.使用聚乳酸可降解塑料可减少白色污染
难度: 简单查看答案及解析
-
阿伏加德罗常数的值为NA,下列说法正确的是( )
A.1L0.1mol/LNaHCO3溶液中,HCO3-和CO32-的总数0.1NA
B.由
和
组成的1molO2中,含有质子的数目为16NA
C.标准状况下,22.4L的乙醇与足量的氧气反应,生成CO2的数目为2NA
D.2molSO2和1molO2于密闭容器内充分反应后,生成SO3的数目为2NA
难度: 中等查看答案及解析
-
薄荷醇(
)是薄荷油的主要成分,下列关于薄荷醇说法正确的是( )
A.能够发生消去反应,且消去产物可能有两种
B.分子式为C10H18O,与有机物A(
)互为同分异构体
C.加入FeCl3溶液变色
D.难溶于乙醇
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、Q、R、T的原子序数依次增大,X的原子半径是所有元素中最小的,Y元素是一种高效电池中的重要材料,Z的一种同位素可用于考古断代,R的最外层电子数是次外层电子数的3倍,T的单质可用于自来水消毒。下列说法错误的是( )
A.Y元素的单质在空气中燃烧只能生成一种氧化物
B.X、Q、R三种元素只能组成酸
C.简单离子半径:Q>R
D.简单氢化物稳定性:R>Q>Z
难度: 中等查看答案及解析
-
下列实验操作和现象及所得到的结论均正确的是( )
选项
实验操作和现象
结论
A
向蛋白质溶液中滴加过量的氯化铵,有固体析出
蛋白质变性
B
向NaI和NaCl混合液中加入大量AgNO3溶液,出现了黄色沉淀
Ksp(AgCl)>Ksp(AgI)
C
向蔗糖溶液中加入稀H2SO4,加热几分钟,冷却后加入新制Cu(OH)2,加热后没有红色沉淀生成
蔗糖还未水解
D
用pH测得:0.1mol/LCH3COOH溶液的pH约为3
发生电离CH3COOH分子约为1%
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
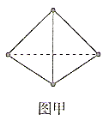
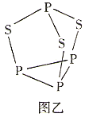
某兴趣小组使用甲烷燃料电池(如图甲所示)作为SO2传感器(如图乙所示)的电源,检测空气中SO2的含量。下列说法错误的是( )


A.甲烷燃料电池M极的电极反应式为CH4-8e-+4O2-=CO2+2H2O
B.甲烷燃料电池的b端连接SO2传感器的c端
C.标准状况下,当甲烷燃料电池的N极消耗2.24L的O2时进入传感器的SO2为4.48L
D.每转移1mol电子,传感器中Ag/AgCl电极质量增加35.5g
难度: 中等查看答案及解析
-
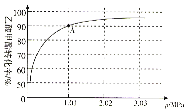
已知Ba3(PO4)2和BaHPO4不溶于水,Ba(H2PO4)2易溶于水,现将0.1mol/LBa(OH)2溶液加入至100mL同浓度的H3PO4溶液中,电流强度(I)与加入Ba(OH)2溶液的体积(V)之间的关系如图所示,下列说法正确的是( )
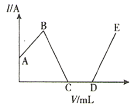
A.A~B段发生的反应为:H3PO4+Ba(OH)2=BaHPO4↓+2H2O
B.B点处加入Ba(OH)2溶液的体积V=10mL
C.C点处沉淀的质量为2.33g
D.D点处沉淀的物质的量为0.01mol
难度: 中等查看答案及解析


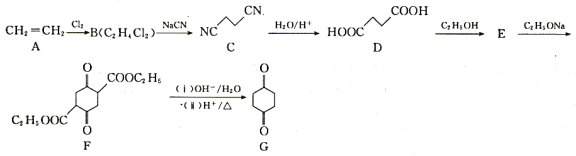
 +C2H5OH
+C2H5OH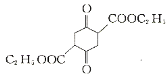 中的手性碳________。
中的手性碳________。