-
某元素R最高价含氧酸的化学式为HaROb,则其最低价气态氢化物中R元素的化合价( )
A. 2b-a B. a-2b C. 8+a-2b D. 2b-a-8
难度: 简单查看答案及解析
-
把甲、乙、丙、丁四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若甲、乙相连,甲为负极;丙、丁相连,丁上有气泡逸出;甲、丙相连,甲上发生氧化反应;乙、丁相连,乙是电子流入的一极。则四种一金属的活动性顺序由大到小排列为
A. 甲>丙>丁>乙 B. 甲>丙>乙>丁
C. 甲>乙>丙>丁 D. 乙>丁>丙>甲
难度: 简单查看答案及解析
-
电解稀H2SO4、CuCl2的混合液,最初一段时间阴极和阳极上分别析出的物质分别是
A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2
难度: 简单查看答案及解析
-
下列各组物质中化学键的类型完全相同的是( )
A.NaCl MgCl2 Na2O
B.H2O Na2O CO2
C.CaCl2 NaOH H2SO4
D.NH4Cl H2O CO2
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A.酸性;H2SO4>H3PO4
B.非金属性:Cl>Br
C.碱性:NaOH>Mg(OH)2
D.热稳定性:Na2CO3>NaHCO3
难度: 简单查看答案及解析
-
用石墨作电极电解下列溶液一段时间后,溶液的pH均增大,再加入一定量括号内的物质,都能使溶液恢复到原来的成分和浓度的是( )
A.AgNO3(AgNO3) B.NaOH (H2O)
C.KCl (KCl) D.CuSO4(CuSO4)
难度: 简单查看答案及解析
-
反应A(g)+3B(g) ⇌2C(g)+2D(g)在四种不同情况下的反应速率分别为( )
①υ(A)=0.45 mol·L-1· s-1 ②υ(B)=0.9mol·L-1·s-1 ③υ(C)=0.4 mol·L-1·s-1 ④υ(D)=0.45mol·L-1·s-1,
该反应进行的快慢顺序为( )
A.②>①=④>③ B.④<③<②<① C.①>②>④>③ D.③>①=④>②
难度: 简单查看答案及解析
-
已知短周期元素的离子aA3+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径A>B>D>C B.离子半径 C3->D->B+>A3+
C.原子序数d>c>b>a D.A与B、C、D的最高价氧化物的水化物都能反应
难度: 中等查看答案及解析
-
关于元素周期表的说法正确的是( )
A.元素周期表有7个周期 B.元素周期表有8个主族
C.ⅠA族的元素全部是金属元素 D.短周期是指第一、二周期
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是
A.铝与稀盐酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
难度: 简单查看答案及解析
-
下列设备工作时,将化学能转化为电能的是
A.锂离子电池
 B.太阳能集热器
B.太阳能集热器 C.燃气灶
C.燃气灶 D.硅太阳能电池
D.硅太阳能电池
难度: 简单查看答案及解析
-
下列图示的装置中可以构成原电池的是
A.
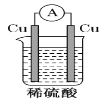 B.
B.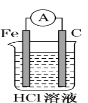 C.
C.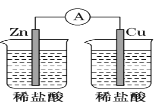 D.
D.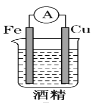
难度: 简单查看答案及解析
-
某元素原子L层电子数是K层电子数的3倍,那么此元素是( )
A.F B.C
C.O D.N
难度: 简单查看答案及解析
-
在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s内平均速率的v(H2)=0.3mol/(L•s),则3s末NH3的浓度为:
A.0.4mol/L B.0.6mol/L C.0.9mol/L D.1.2mol/L
难度: 简单查看答案及解析
-
一个5L的容器里,盛入8.0mol某气态反应物,5min后,测得这种气态反应物还剩余6.8mol,这种反应物的化学反应速率为( )
A.0.012mol/(L·min) B.0.024mol/(L·min)
C.0.036mol/(L·min) D.0.048mol/(L·min)
难度: 简单查看答案及解析
-
下列化学用语不正确的是
A.氮分子的电子式
B.CO2的电子式:
C.NH4Cl的电子式:
D.用电子式表示HCl的形成过程
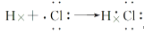
难度: 简单查看答案及解析
-
下列热化学方程式中,正确的是( )
A.甲烷燃烧热为890.3 kJ•mol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=+890.3 kJ•molˉ1
B.稀盐酸和稀氢氧化钠溶液混合,其热化学方程式为:H++OH-=H2O △H=-57.3 kJ•molˉ1
C.H2燃烧热为285.8kJ•molˉ1,燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ•molˉ1
D.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H=-38.6 kJ·mol-1
难度: 中等查看答案及解析
-
已知R2-离子的核内有n个中子,R的质量数为M,则mgR2-离子里含有电子的物质的量为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
通常人们把拆开1mol化学键吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热.下列是一些化学键的键能.
化学键
C﹣H
C﹣F
H﹣F
F﹣F
键能/(kJ•mol﹣1)
414
489
565
155
根据键能数据估算反应CH4+4F2═CF4+4HF每消耗1molCH4的热效应( )
A. 放热1940kJ B. 吸热1940kJ C. 放热485kJ D. 吸热485kJ
难度: 简单查看答案及解析
-
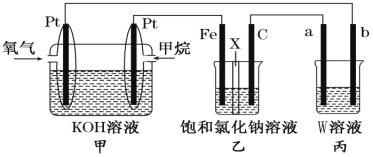
下列实验装置符合实验目的是( )
目的
粗铜的精炼
验证NaCl溶液(含酚酞)的产物
在铁制品上镀铜
构成原电池
装置
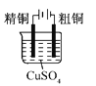
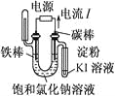
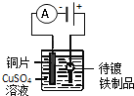
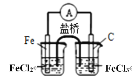
选项
A
B
C
D
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
当电解质中某离子的浓度越大时,其氧化性或还原性越强。利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法错误的是
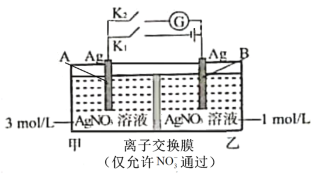
A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池Ag+浓度相等
B.断开K1、闭合K2,当转移0.1mol e-时,乙池溶液质量增加17.0 g
C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大
难度: 中等查看答案及解析