-
下列关于甲烷的说法不正确的是
A.是天然气的主要成分 B.难溶于水
C.不能使酸性高锰酸钾溶液褪色 D.与氯气发生加成反应
难度: 简单查看答案及解析
-
某元素最高价氧化物对应水化物的化学式为H2XO3。这种元素的气态氢化物的化学式是( )
A.HX B.H2X C.XH3 D.XH4
难度: 简单查看答案及解析
-
下列化学性质中,烷烃不具备的是
A.一定条件下发生分解反应 B.可以在空气中燃烧
C.与氯气发生取代反应 D.能使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.镍镉电池、锂电池和锌锰电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应原理是氧化还原反应
D.铅蓄电池放电时正极是Pb,负极是PbO2
难度: 简单查看答案及解析
-
通常用来衡量一个国家石油化工发展水平标志的是
A.甲烷的产量 B.苯的产量 C.乙醇的产量 D.乙烯的产量
难度: 简单查看答案及解析
-
下列有关常见有机物的说法正确的是( )
A.植物油和裂化汽油都能使溴水褪色
B.乙烯与溴水、苯与液溴发生的反应都属于取代反应
C.乙醇和乙酸都能与NaOH溶液反应
D.淀粉、氨基酸和蛋白质均为天然高分子化合物
难度: 简单查看答案及解析
-
下列试剂中不能用于鉴别乙醇和乙酸的是( )
A.金属Na B.酸性KMnO4溶液 C.溴水 D.NaHCO3溶液
难度: 简单查看答案及解析
-
下列物质,都能与Na反应放出H2,其产生H2的速率排列顺序正确的是( )
①C2H5OH ②稀盐酸 ③H2O
A.①>②>③ B.②>①>③
C.③>①>② D.②>③>①
难度: 简单查看答案及解析
-
关于乙酸的下列叙述中错误的是( )
A.乙酸是有刺激性气味的液体,是食醋的主要成分
B.乙酸具有酸的通性,可以使石蕊等指示剂变色
C.乙酸在常温下可以发生酯化反应
D.乙酸可以和NaHCO3溶液反应放出CO2
难度: 简单查看答案及解析
-
下列有关物质水解的说法正确的是( )
A.蛋白质水解的最终产物是多肽
B.淀粉水解的最终产物是麦芽糖
C.纤维素不能水解成葡萄糖
D.油脂水解产物之一是甘油
难度: 简单查看答案及解析
-
运动员无论是在比赛或者是训练时都是需要大量的体力消耗,需比较快地补充能量,可以饮用葡萄糖水。则葡萄糖在人体内发生的主要反应是( )
A.酯化反应 B.氧化反应 C.还原反应 D.水解反应
难度: 简单查看答案及解析
-
下列各组物质中,化学键类型完全相同的是
A.SO2和NaOH B.CO2和H2O C.Cl2和HCl D.CCl4和KCl
难度: 简单查看答案及解析
-
下列有关叙述不正确的是
A.第三周期元素形成的简单离子的半径依次减小
B.HClO4、H2SO4、H3PO4、H2SiO3的酸性依次减弱
C.HCl、H2S、PH3的稳定性依次减弱
D.Na+、Mg2+、Al3+的氧化性依次增强
难度: 简单查看答案及解析
-
元素周期律的实质是
A.相对原子质量逐渐增大 B.核电荷数逐渐增大
C.核外电子排布呈周期性变化 D.元素化合价呈周期性变化
难度: 简单查看答案及解析
-
关于
F-微粒叙述正确的是
A.质量数为19,电子数为9 B.质子数为9,中子数为10
C.质子数为9,电子数为9 D.中子数为10,电子数为8
难度: 简单查看答案及解析
-
某元素原子L层电子数是K层电子数的2倍,那么此元素是( )
A.F B.C C.O D.N
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A.化学键只存在于分子之间 B.化学键只存在于离子之间
C.形成化学键的微粒可以是原子也可以是离子 D.化学键是相邻的分子之间强烈的相互作用
难度: 简单查看答案及解析
-
下列关于化学键的叙述正确的是( )
A.离子化合物可能含共价键,共价化合物中不含离子键
B.共价化合物可能含离子键,离子化合物中只含离子键
C.构成单质分子的微粒一定含有共价键
D.在氯化钠中,只存在氯离子和钠离子的静电吸引作用
难度: 简单查看答案及解析
-
下列措施对增大化学反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.在K2SO4与BaCl2两溶液反应时增大压强
C.Fe与硫酸反应制氢气时,加入适量固体K2SO4
D.Al在氧气中燃烧生成Al2O3,将铝片改成铝粉
难度: 简单查看答案及解析
-
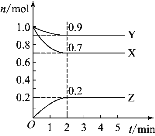
反应A(g)+3B(g)
2C(g)在2L密闭容器中反应,半分钟内C的物质的量增加了0.6mol,有关反应速率中正确的是
A.v(A)=0.005 mol·L-1·s-1 B.v(C)=0.02 mol·L-1·s-1
C.v(B)= v(A)/3 D..v(A)=0.01mol·L-1·s-1
难度: 简单查看答案及解析
-
可逆反应N2+3H2
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
难度: 中等查看答案及解析
-
在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A.正极附近的SO42―离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
难度: 简单查看答案及解析
-
常用的纽扣电池为银锌电池,它分别以锌和氧化银为电极。放电时锌极上的电极、反应是Zn+2OH--2e-===Zn(OH)2,氧化银极上的反应是Ag2O+H2O+2e-===2Ag+2OH-,下列判断中正确的是( )
A.锌是负极,发生氧化反应,氧化银是正极,发生还原反应
B.锌是正极,发生氧化反应,氧化银是负极,发生还原反应
C.锌是负极,发生还原反应,氧化银是正极,发生氧化反应
D.锌是正极,发生还原反应,氧化银是负极,发生氧化反应
难度: 简单查看答案及解析
-
下列叙述错误的是( )
A.一定条件下的可逆反应达到限度时,此条件下反应物的转化率最大
B.化学反应限度的大小主要取决于反应物的性质,且随条件的改变而改变
C.化学反应限度随外界条件的改变而改变的根本原因是外界条件的改变引起v正≠v逆
D.可逆反应的正反应的限度大,正反应的速率就大
难度: 简单查看答案及解析
-
一定温度下,某一密闭且体积不变的容器内有可逆反应X(g)⇌3Y(g)+2Z(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )
A.单位时间内生成a mol物质X,同时生成3a mol物质Y
B.单位时间内生成a mol物质X,同时消耗2a mol物质Z
C.没有X这种物质
D.X、Y、Z的分子数之比为1∶3∶2
难度: 简单查看答案及解析
-
化学能可与热能、电能等相互转化。下列表述不正确的是( )
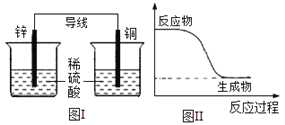
A. 化学反应中能量变化的主要原因是化学键的断裂与形成
B. 能量变化是化学反应的基本特征之一
C. 图I所示的装置能将化学能转变为电能
D. 图II所示的反应为放热反应
难度: 简单查看答案及解析
-
对于反应Zn+H2SO4=ZnSO4+H2↑,1 mol Zn反应时放出Q kJ热量。下列叙述不正确的是( )
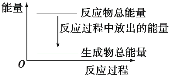
A.反应过程中的能量关系可用如图表示 B.滴入少许CuSO4溶液后反应速率减小
C.若将该反应设计成原电池,则锌为负极 D.理论上当转移4 mol电子时放出2QkJ热量
难度: 中等查看答案及解析
-
在2A(g)+B(g)⇌3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.乙烯的最简式:C2H4
B.乙醇的结构简式:C2H6O
C.四氯化碳的电子式:
D.乙烯可以使溴水褪色
难度: 中等查看答案及解析
-
下列反应中属于加成反应的是( )
A. CH4+Cl2
CH3Cl+HCl
B. CH2=CH2+HCl →CH3CH2Cl
C. CH3CH2OH+HBr
CH3CH2Br+H2O
D. 2CH3CH3+7O2
4CO2+6H2O
难度: 简单查看答案及解析