-
下列有关说法正确的是 ( )
A.电子云通常用小黑点的疏密来表示,小黑点密表示在该空间的电子数多
B.已知Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为4f5
C.Cu的核外电子排布为 1s22s22p63s23p63d104s1,所以Cu处于s区
D.原子光谱的特征谱线用于鉴定元素,从1s22s22p33s1跃迁至1s22s22p4时形成是吸收光谱
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p4。则下列有关比较中正确的是( )
A.第一电离能:③>④>②>① B.原子半径:②>①>④>③
C.电负性:④>③>②>① D.最高正化合价:①=④>②=③
难度: 中等查看答案及解析
-
新型冠状病毒对紫外线和热敏感,有些方法还是可以有效灭活病毒的,下列说法错误的是
A.疫苗一般应冷藏存放
B.75%的酒精杀菌消毒的原理是使蛋白质变性
C.含氯消毒剂(如84消毒液)使用过程中有化学反应发生
D.过氧乙酸(CH3COOOH)中氧原子的杂化方式为sp
难度: 简单查看答案及解析
-
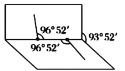
元素周期表中铋元素的数据如图,下列说法正确的是

A.Bi元素的质量数为209 B.Bi元素在周期表中的位置位于第六周期IIIA族
C.Bi原子有3个未成对电子 D.Bi原子最外层有5个能量相同的电子
难度: 简单查看答案及解析
-
下列关于原子核外电子排布与元素在周期表中位置关系的叙述正确的是( )
A.基态原子核外N电子层上只有一个电子的元素一定是第ⅠA族元素
B.原子核外价电子排布式为(n-1)d6~8ns2的元素一定是副族元素
C.基态原子的p能级上半充满的元素一定位于p区
D.基态原子核外价电子排布式为(n-1)dxnsy的元素的族序数一定为x+y
难度: 中等查看答案及解析
-
下列图像中所发生的现象与电子的跃迁无关的是( )
A. 燃放烟花
 B. 霓虹灯广告
B. 霓虹灯广告
C. 燃烧蜡烛
 D. 平面镜成像
D. 平面镜成像
难度: 中等查看答案及解析
-
以下是一些原子的
能级和
能级中电子排布的情况,其中违反了洪特规则的是( )
①
②
③
④
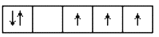
⑤
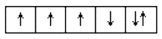
⑥
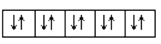
A.①②④ B.①③④ C.③④⑤ D.②④⑤
难度: 中等查看答案及解析
-
在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子的最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。下列说法正确的是
A.B元素在周期表中的d区
B.元素C核外有6种能量不同的电子
C.E的气态氢化物沸点最高的原因是HE分子内形成氢键
D.元素D的电子排布式为[Ar]4s24p5
难度: 中等查看答案及解析
-
某元素的第一电离能至第五电离能(kJ/mol)如下:
I1
I2
I3
I4
I5
737
1451
7732
10540
13630
下列说法正确的是
A.该元素有可能是Be或者Mg
B.该元素电离能数据的第二次突跃可能出现在I10
C.该元素的第一电离能比它同周期的相邻两种元素均要高
D.第VIIA族元素A与该元素的原子B形成的化合物化学式为AB2
难度: 简单查看答案及解析
-
下列说法中正确的是
A.同周期的所有元素,从左到右,电负性依次增大
B.在H3O+和[Cu(NH3)4]2+中都存在配位键,因此它们形成的都是配位化合物
C.焰色反应本质上就是发射光谱
D.SO2、CO2都是极性分子
难度: 简单查看答案及解析
-
X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
元素
相关信息
X
X的基态原子L层电子数是K层的2倍
Y
Y的基态原子最外层电子排布式为nsnnpn+2
Z
Z存在质量数为23,中子数为12的核素
W
W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色
下列说法不正确的是
A.W形成的最稳定离子价电子排布式为3d5 B.X与Y的最简单氢化物杂化方式相同
C.Z2Y2中阴离子和阳离子个数比为1:1 D.XY2的空间构型为直线形分子
难度: 简单查看答案及解析
-
用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是
A.砷原子的结构示意图
 B.
B.的结构式
C.HF分子间的氢键H-F-H D.丙氨酸的手性异构
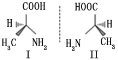
难度: 简单查看答案及解析
-
下列对分子的性质的解释中,不正确的是
A.HCl、Cl2与H2分子中均含有σ键,且σ键为轴对称
B.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
C.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
D.水光卤气(COCl2)、甲醛分子的立体构型和键角均完全相同
难度: 简单查看答案及解析
-
第VA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是
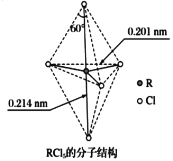
A.每个原子都达到8电子稳定结构
B.分子中5个R-Cl键键能相同
C.键角(Cl-R-Cl)有90°、120°、180°几种
D.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
难度: 中等查看答案及解析
-
下列关于物质结构与性质的说法正确的是
A.标况下,22.4 L C2H2中所含的π键数和18 g冰中所含的氢键数均为2NA
B.由于氢键的作用NH3、H2O、HF的沸点反常,且高低顺序为HF>H2O>NH3
C.VSEPR模型就是分子的空间构型
D.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
难度: 中等查看答案及解析
-
东阿广场十一期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如图,下列关于该物质的说法正确的是
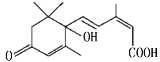
A.其分子式为C15H22O4
B.1 mol该物质与足量NaOH溶液反应,最多消耗2 mol NaOH
C.既能发生加聚反应,又能发生缩聚反应
D.该物质中sp3杂化的C原子和氧原子形成的化学键键角相同
难度: 中等查看答案及解析
-
下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是
①
②
③
④
⑤CH3CH2OH⑥C6H12O6⑦CH3COOH⑧硬脂酸甘油酯⑨蛋白质⑩聚乙烯
A.能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B.含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
C.属于高分子材料的是⑧⑨⑩
D.投入钠能产生H2的是⑤⑦⑧⑨
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是( )
A.油脂在人体内水解为氨基酸和甘油等小分子后被人体吸收
B.甲酸甲酯(HCOOCH3)和乙酸是同分异构体
C.石油催化裂化的主要目的是提高芳香烃的产量
D.聚丙烯的结构简式为
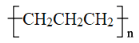
难度: 简单查看答案及解析
-
下列说法正确的是
A.键角:BF3>CH4>H2O>NH3
B.
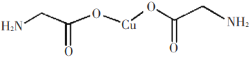 中σ键和π键比例为7:1
中σ键和π键比例为7:1C.已知二茂铁(Fe(C5H5)2)熔点是173
(在100
时开始升华),沸点是249
,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,
与Fe2+之间是以离子键相结合
D.在硅酸盐中,
四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同
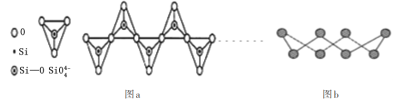
难度: 中等查看答案及解析
 D.
D.