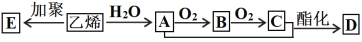-
“绿水青山就是金山银山”,下列做法有利于环境保护和可持续发展的是( )
A.大量生产一次性超薄塑料袋方便日常生活
B.对所有垃圾以直接露天焚烧的方式进行处理
C.加大农药和化肥的生产和使用量,以提高粮食的产量
D.推行绿色设计、绿色工艺、开发绿色产品,从源头上消除污染
难度: 简单查看答案及解析
-
下列关于
说法正确的是( )
A.中子数为60 B.质量数为87
C.核电荷数为27 D.核外电子数为33
难度: 简单查看答案及解析
-
下列表示正确的是( )
A.N2的结构式: N≡N B.甲烷分子的球棍模型是:
C.乙烯的结构简式:CH2CH2 D.NaCl的电子式:
难度: 简单查看答案及解析
-
下列物质属于同分异构体的是( )
A.
和
B.O2与O3
C.正丁烷与异丁烷 D.乙烷与丙烷
难度: 简单查看答案及解析
-
不断进步的材料逐渐构筑了现代文明社会,下列说法不正确的是( )
A.“唐三彩”和景德镇陶瓷均属于无机非金属材料
B.以高纯硅制成的光导纤维内窥镜可以用于医疗
C.钛制人造关节可以和人骨密切结合,钛被人们称为“亲生物金属”
D.用于制作N95口罩的“熔喷布”主要原料是聚丙烯,聚丙烯属于有机高分子材料
难度: 简单查看答案及解析
-
下列变化过程需破坏离子键的是( )
A.干冰升华 B.电解水 C.食盐熔化 D.氯化氢溶于水
难度: 简单查看答案及解析
-
对于化学反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,下列措施(其他条件一定)不能增大反应速率的是( )
A.增大HCl溶液的浓度 B.粉碎CaCO3固体
C.升高反应体系的温度 D.减小反应体系的压强
难度: 简单查看答案及解析
-
下列现象因发生取代反应而产生的是
A.甲烷与氯气混合,光照一段时间后黄绿色消失
B.将苯加入溴水中,振荡后水层接近无色
C.乙烯使溴的四氯化碳溶液褪色
D.乙烯使酸性KMnO4溶液褪色
难度: 简单查看答案及解析
-
同一短周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性:HZO4>H2YO4>H3XO4,则下列判断正确的是( )
A.原子半径:X>Y>Z B.气态氢化物的稳定性:XH3>H2Y>HZ
C.非金属性:X>Y>Z D.阴离子的还原性:Z->Y2->X3-
难度: 简单查看答案及解析
-
某小组设计的化学电池使LED灯发光的装置如图所示,下列叙述正确的是( )
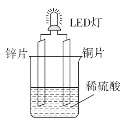
A.锌片为正极,铜片为负极 B.锌片质量减轻,发生还原反应
C.电子由铜片通过稀硫酸流向锌片 D.装置中存在“化学能→电能→光能”的转换
难度: 简单查看答案及解析
-
反应2SO2(g)+O2(g)
2SO3(g)的能量变化如图所示,下列说法不正确的是( )
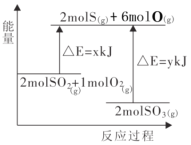
A.该正反应为放热反应
B.该反应物总能量高于生成物总能量
C.吸热反应一定要加热后才能发生
D.2molS(g)、6molO(g) 生成2molSO3(g),共放出y kJ能量
难度: 简单查看答案及解析
-
苹果酸分子的结构简式为
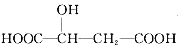 ,下列说法正确的是( )
,下列说法正确的是( )A.苹果酸属于烃 B.苹果酸能发生取代反应
C.苹果酸分子式为C4H8O5 D.1mol苹果酸可与3molNaOH发生反应
难度: 简单查看答案及解析
-
短周期元素X、Y、Z在周期表中的位置关系如图所示,则下列叙述正确的是( )
X
Y
Z
A.X一定是活泼的非金属元素 B.Y元素的最高正价为+7价
C.Z单质比Y单质更易与氢气化合 D.Z的最高价氧化物化学式为ZO3
难度: 中等查看答案及解析
-
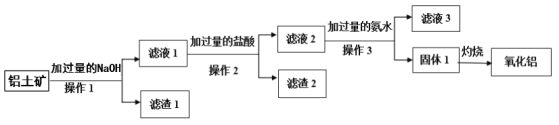
下列物质转化在给定条件下能实现的是( )
①Cu
CuO
Cu(NO3)2
②Si
SiO2
H2SiO3
③Al2O3
Na[Al(OH)4]
AlCl3
④Fe
FeCl3
FeCl3
A.①③ B.②③ C.②④ D.①④
难度: 简单查看答案及解析
-
下列实验操作能达到预期目的是( )
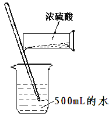
A.配制500mL 0.1 mol·L-1的硫酸溶液
 B.处理氨气
B.处理氨气 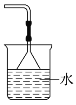
C.利用排空气法收集氯气
D.分离乙醇和水
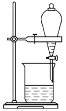
难度: 简单查看答案及解析
-
对水样中M的分解速率的影响因素进行研究。在相同温度下,M的物质的量浓度 [c(M)]随时间(t) 变化的有关实验数据如下图所示,下列说法不正确的是( )

A.水样的PH越小,M的分解速率越快
B.水样中添加Cu2+,能加快M的分解速率
C.由②③得,反应物浓度越大,M的分解速率越快
D.在0~20min内,②中M的平均分解速率为0.015mol·L-1·min-1
难度: 中等查看答案及解析