-
化学与生产、生活、社会密切相关,下列有关说法中正确的是( )
A.地沟油经过加工处理后可用来制生物柴油和肥皂
B.油脂在人体内水解为氨基酸和甘油等小分子物质后才能被吸收
C.“长征三号甲系列火箭”外表面使用的高温结构陶瓷的主要成分是硅酸盐
D.黑火药爆炸过程中发生氧化还原反应,其中氧化剂仅有KNO3
难度: 中等查看答案及解析
-
已知NA是阿伏加德罗常数的值,下列说法中错误的是
A.100 mL 3 mol/LNH4NO3溶液中含有的NH4+的数目小于0.3NA
B.1 mol Al3+完全水解生成氢氧化铝胶体粒子的数目为NA
C.密闭容器中2 mol NO与1 mol O2充分反应后,混合物中氧原子数为4NA
D.1 mol甲基中含有的共用电子对数目为3NA
难度: 中等查看答案及解析
-
双烯酮
是精细化学品染料、医药、农药、食品和饲料添加剂、助剂等的原料。下列关于双烯酮的说法中错误的是( )
A.分子式为C4H4O2
B.分子中所有原子处于同一平面
C.能与NaOH溶液发生反应
D.能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W元素原子的最外层电子数是其电子层数的2倍;X和Y元素原子的最外层电子数之和与W元素原子的最外层电子数相同;X与Z形成的离子化合物的水溶液呈中性。下列说法中正确的是( )
A.X的氧化物均为碱性氧化物
B.工业采用电解Y的熔融氯化物制取Y单质
C.将F2通入X与Z形成的化合物水溶液中,可置换出Z单质
D.W的简单氢化物沸点在同主族元素简单氢化物中最低
难度: 中等查看答案及解析
-
下列实验操作和实验现象得出的结论中正确的是( )
选项
实验操作
实验现象
结论
A
向5 mL0.1 mol/LKI溶液中加入0.1 mol/LFeCl3溶液10 mL,振荡,用苯萃取数次后取下层溶液,滴加5滴KSCN溶液
出现红色
Fe3+与I-之间的反应是有一定限度的
B
将己烯加入溴水中,振荡、静置,测溴水层溶液前后的pH
溶液pH增大
说明己烯发生加成反应,不是取代反应
C
用pH计分别测定饱和SO2溶液和饱和CO2溶液的pH
饱和SO2溶液的pH小
酸性:H2SO3>H2CO3
D
向酸性高锰酸钾溶液中滴加甲苯
溶液褪色
甲基对苯环产生影响
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )
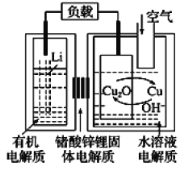
A.该电池的负极为Li
B.通空气时,铜被腐蚀,表面产生Cu2O
C.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
D.若有1 mol Li+透过固体电解质时,标准状况下参与反应的O2体积为5.6 L
难度: 中等查看答案及解析
-
已知:H3AO3与足量NaOH溶液反应生成NaH2AO3,25℃时,K(H3AO3)=9.7×10-11。常温下,用0.100mol/L盐酸滴定20.00mL0.100mol/L NaH2AO3溶液。溶液中c(
)与-lgc(OH-)的变化关系如图所示。下列说法中正确的是( )
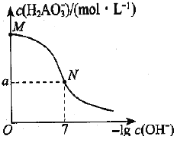
A.H3AO3为三元酸
B.溶液中水电离程度为:M<N
C.a>0.05
D.M到N过程中,溶液中存在c(Na+)=c(
)+c(H3AO3)
难度: 中等查看答案及解析
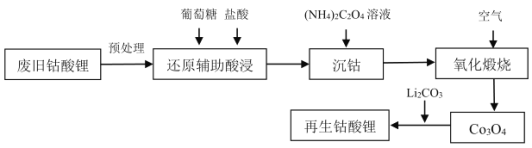
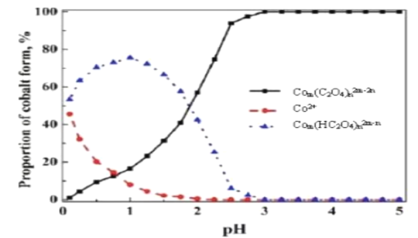
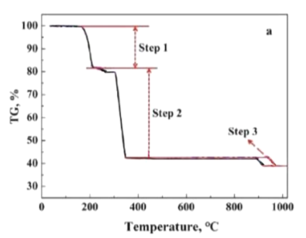
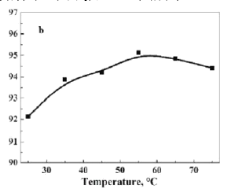
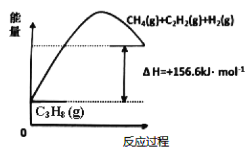
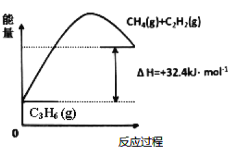
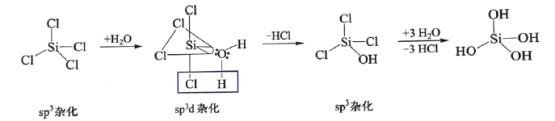
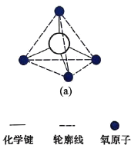
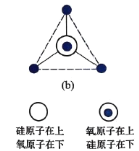
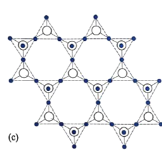
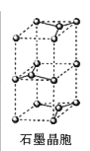
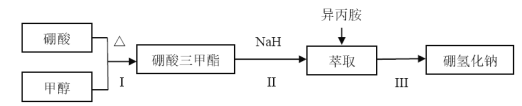
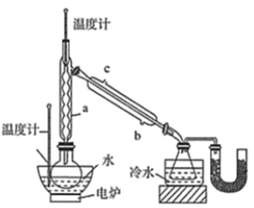
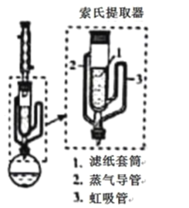
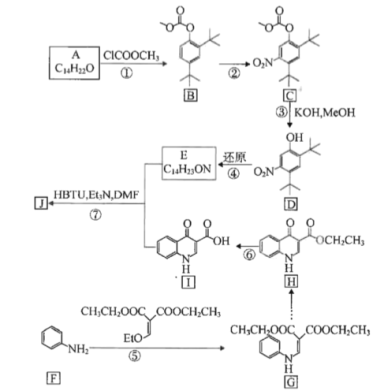
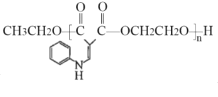 。若反应⑤生成C2H5OH总质量为460 g,则生成物的n值理论上应等于__________。
。若反应⑤生成C2H5OH总质量为460 g,则生成物的n值理论上应等于__________。