-
丙烯(C2H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)⇌C3H6(g)+H2(g) ∆H=____________kJ/mol
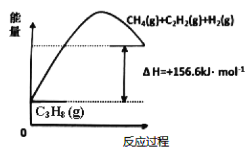
①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是________。
②目前在丙烷脱氢制丙烯时常通入适量的O2,让其同时发生下列反应:2C3H8(g) +O2(g)⇌2C3H6(g)+2H2O(g) ∆H=-235kJ/mol,通入O2的目的是_______。
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8(g)+C2H4(g)⇌2C3H6(g) ∆H>0
①某温度下,上述反应中,正反应速率为v正=K正c(C4H8)∙c(C2H4)、逆反应速率为v逆=K逆c2(C3H6),其中K正、K逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是_____________
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使K正和K逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应程度无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___________25%(填“>”、“<”、“=”)。
(3)工业上可用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
Ⅰ. CH2=CHCH3(g)+Cl2(g)⇌CH2ClCHClCH3(g)
II. CH2=CHCH3(g)+Cl2(g)⇌CH2=CHCH2Cl(g)+HCl(g)
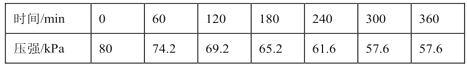
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应Ⅰ,容器内气体的压强随时间的变化如表所示。
| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即 ,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPa∙min-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPa∙min-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
-
丙烯(C3H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯乙烯、异丙烯等产品。
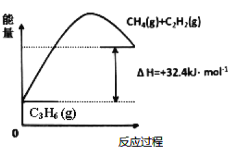
(1)丙烷脱氢制备丙烯。由图可得C3H8(g) C3H6(g)+H2(g) ΔH=___kJ/mol。
C3H6(g)+H2(g) ΔH=___kJ/mol。
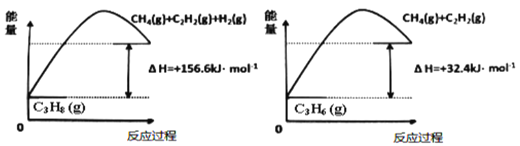
①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___。
②目前在丙烷脱氢制丙烯时常加入适量的O2,让其同时发生下列反应:
2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8+C2H4 2C3H6(g) ΔH>0。
2C3H6(g) ΔH>0。
①某温度下,上述反应中,正反应速率为v正=k正c(C4H8)c(C2H4)、逆反应速率为v逆=k逆c2(C3H6),其中k正、k逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是___。
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使k正和k逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应历程无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___25%。(填“>”、“<”、“=”)
(3)工业上可用丙烯加成法制备1,2—二氯丙烷(CH2ClCHClCH3),主要副产物为3—氯乙烯(CH2=CHCH2Cl),反应原理为
Ⅰ.CH2=CHCH3(g)+Cl2(g) CH2ClCHClCH3(g)
CH2ClCHClCH3(g)
Ⅱ.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)
CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
①用单位时间内气体分压的变化来表示反应速率,即v= ,则前120min内平均反应速率v(CH2ClCHClCH3)=___kPa•min-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=___kPa•min-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__kPa-1。(Kp为以分压表示的平衡常数,保留小数点后2位。)
-
丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等.
Ⅰ.(1)以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,反应为:C4H8(g)+C2H4(g) 2C3H6(g)。已知:
2C3H6(g)。已知:
①C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H 1=-1411KJ•mol-1
②C3H6(g)+ O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJ•mol-1
O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJ•mol-1
③C4H8(g)+6O2(g)═4CO2(g)+4H2O(l)△H 3=-2539KJ•mol-1
“烯烃歧化法”的反应的热化学方程式为_____________________。
(2)一定温度下,在一体积恒为 V 升的密闭容器中充入一定量的 C4H8 和 C2H4,发生烯烃歧化法的 主要反应。 t1 时刻达到平衡状态,此时容器中 n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=b mol, 且 C3H6 占平衡总体积的 1/4。
①求该时间段内的反应速率 v(C4H8)=_____________。 (用只含 a、V、t1 的式子表示)
②判断该反应达到平衡的标志是______________
A.2v (C4H8) 生成=v (C3H6) 消耗
B.C4H8、C2H4、C3H6 的物质的量之比为 1:1:2
C.混合气体的平均相对分子质量不再改变
D.C4H8、C2H4、C3H6 的浓度均不再变化
(3)Kp 是用反应体系中气体物质的分压来表示的平衡常数,即将 K 表达式中平衡浓度用平衡分压代替。已知反应﹕C4H8(g)+C2H4(g) 2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
Ⅱ.“丁烯裂解法”是另一种重要的丙烯生产法,但生产过程中会有生成乙烯的副反应发生.反应如下主反应:3C4H8 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(P)变化的趋 势分别如图 1 和图 2 所示:
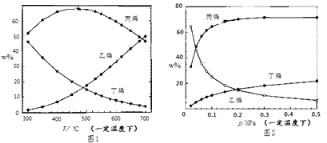
(1)平衡体系中的丙烯和乙烯的质量比是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图 1 和图 2 中表现的趋势来看,下列反应条件最适宜的是_____(填字母序号).
A.300oC 0.1MPa B.700oC 0.1MPa C.300oC 0.5MPa D.700oC 0.5MPa
(2)有研究者结合图 1 数据并综合考虑各种因素,认为 450℃的反应温度比 300℃或 700℃更合适, 从反应原理角度分析其理由可能是________________.
(3)图2中,随压强增大平衡体系中丙烯的百分含量呈上升趋势,从平衡角度解释其原因是____________。
-
丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
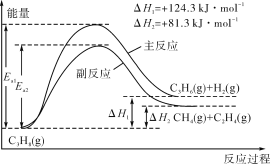
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)__(填“增大”“减小”或“不变”,下同),转化率α(C3H8)__。
②温度升高,副反应更容易发生的主要原因是__。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。
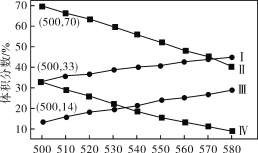
①104Pa时,图中表示丙烯的曲线是__(填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
②104Pa、500℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=__(已知:气体分压=气体总压×体积分数)。
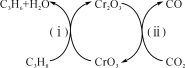
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
已知:CO和H2的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-1。
①图中催化剂为__。
②298K时,该工艺总反应的热化学方程式为__。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__。
-
丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图。
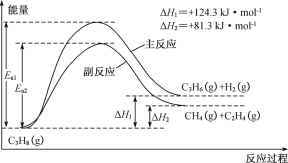
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)____(填“增大”、“减小”或“不变”,下同),转化率α(C3H8)_____。
②温度升高,副反应更容易发生的主要原因是__________________________________。
(2)下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分
别为104 Pa和105 Pa)。
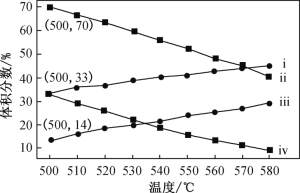
①104 Pa时,图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②104 Pa、500 ℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=_____(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。
该工艺可采用铬的氧化物为催化剂,其反应机理如图。
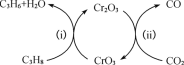
已知:CO和H2的燃烧热分别为△H =-283.0 kJ·mol-1、△H =-285.8 kJ·mol-1。
①图中催化剂为______。
②298 K 时,该工艺总反应的热化学方程式为_____________________________________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__________。
-
丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
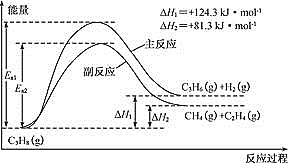
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)______(填“增大”、“减小”或“不变”)
②温度升高,副反应更容易发生的主要原因是:_____________________________。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)
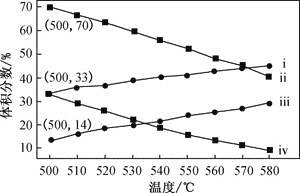
①104Pa时,图中表示丙烯的曲线是_________(填“i”、“ii”、“iii”或“iv”)
②104Pa、500℃时,主反应用平衡分压代替平黄浓度表示的化学平衡常数Kp=______(已知:气体分压=气体总压×体积分数)
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图
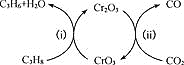
已知:CO和H2的燃烧热分别为∆H=-283.0kJ·mol-1、∆H=-285.8kJ·mol-1
①图中催化剂为___________。
②298K时,该工艺总反应的热化学方程式为____________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是____________。
-
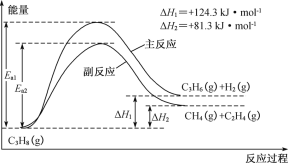
丙烯(C3H6)是重要的有机化工原料。丙烷直接脱氢制丙烯发生的主要反应及能量变化如图:
回答下列问题:
(1)丙烷直接脱氢制丙烯为强吸热过程,该反应必须在高温下进行,但温度越高副反应进行程度越大,同时还会降低催化剂的活性和选择性。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)___(填“增大”、“减小”或“不变”)。
②温度升高,副反应更容易发生的主要原因是_______。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强p1、p2分别为1×104 Pa和1×105 Pa)。
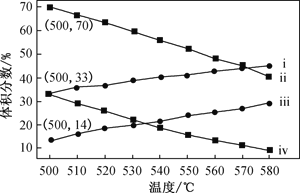
①1×104 Pa时,如图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②1×105Pa、500℃时,若只发生上述主反应和副反应,则达平衡时,丙烷转化为丙烯的转化率为____。
(3)为克服丙烷直接脱氢法的缺点,科学家探索出在无机膜反应器中进行丙烷脱氢制丙烯的技术。在膜反应器中,利用特定功能膜将生成的氢气从反应区一侧有选择性地及时移走。与丙烷直接脱氢法相比,该方法的优点是__________。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
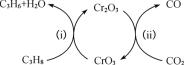
已知:CO和H2的燃烧热分别为△H =-283.0kJ/mol、△H =-285.8kJ/mol。
①反应(ⅰ)的化学方程式为_____。
②25℃时,该工艺总反应的热化学方程式为________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是_______。
-
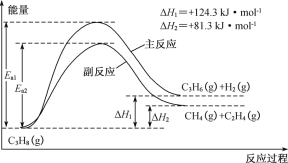
丙烯(C3H6)是重要的有机化工原料。丙烷直接脱氢制丙烯发生的主要反应及能量变化如图:
回答下列问题:
(1)丙烷直接脱氢制丙烯为强吸热过程,该反应必须在高温下进行,但温度越高副反应进行程度越大,同时还会降低催化剂的活性和选择性。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)___(填“增大”、“减小”或“不变”)。
②温度升高,副反应更容易发生的主要原因是_______。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强p1、p2分别为1×104 Pa和1×105 Pa)。
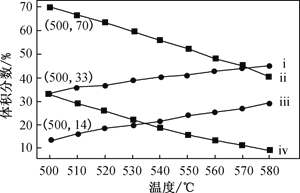
①1×104 Pa时,如图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②1×105Pa、500℃时,若只发生上述主反应和副反应,则达平衡时,丙烷转化为丙烯的转化率为____。
(3)为克服丙烷直接脱氢法的缺点,科学家探索出在无机膜反应器中进行丙烷脱氢制丙烯的技术。在膜反应器中,利用特定功能膜将生成的氢气从反应区一侧有选择性地及时移走。与丙烷直接脱氢法相比,该方法的优点是__________。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
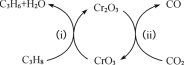
已知:CO和H2的燃烧热分别为△H =-283.0kJ/mol、△H =-285.8kJ/mol。
①反应(ⅰ)的化学方程式为_____。
②25℃时,该工艺总反应的热化学方程式为________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是_______。
-
丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+ O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+ O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___;该反应的平衡常数Kp=___Pa。若提高C3H8的平衡转化率,可采取的措施有___(填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___5(填“>”或“<”)。
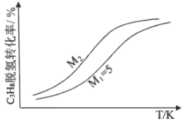
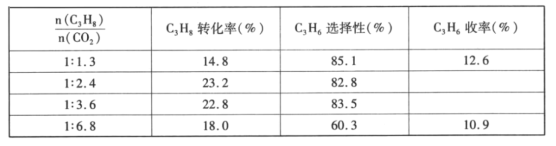
(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是___。反应气中 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时 的配比是___。
的配比是___。
-
丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+ O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+ O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___;该反应的平衡常数Kp=___Pa。若提高C3H8的平衡转化率,可采取的措施有___(填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___5(填“>”或“<”)。
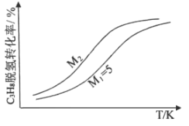
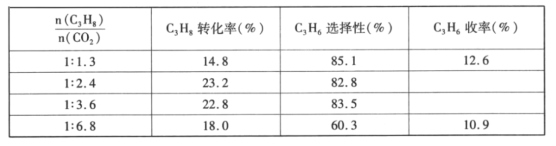
(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是___。反应气中 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时 的配比是___。
的配比是___。


,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPa∙min-1。





















