-
中国人民在悠久的历史中创造了绚丽多彩的中华文化,下列说法正确的是( )
A.《抱朴子》中“丹砂(HgS)烧之成水银,积变又还成丹砂”,描述的是升华和凝华过程
B.成语“金戈铁马”中的金属,在常温下能溶于浓硝酸
C.对敦煌莫高窟壁画颜料分析,其绿色颜料铜绿的主要成分是碱式碳酸铜
D.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
难度: 简单查看答案及解析
-
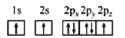
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,9.5g羟基(—18OH)含有的中子数为5NA
B.MnO2与足量浓盐酸反应产生22.4LCl2时转移电子数目为2NA
C.1mol甲烷与1mol氯气光照条件下发生取代反应生成的CH3Cl的分子数为NA
D.1mol铁在一定条件下分别和氧气、氯气、硫完全反应转移电子数都为2NA
难度: 中等查看答案及解析
-
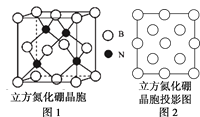
2019年是“国际化学元素周期表年”。W、X、Y、Z均为短周期元素,原子序数依次增加,其中W、X、Z组成的化合物M、N、R之间存在如图所示的反应。下列叙述正确的是
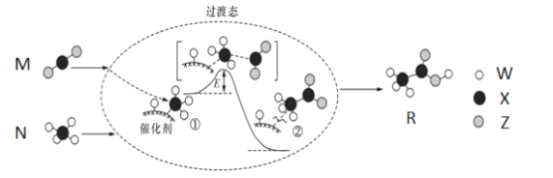
A.元素非金属性的顺序为X>Y>Z>W
B.M、N、R三种分子中,所有原子均满足8电子稳定结构
C.M、N、R三种分子均含有极性键和非极性键
D.W、X、Y、Z四种元素既可形成离子化合物,又可形成共价化合物
难度: 中等查看答案及解析
-
下列关于2—环己基丙烯(
)和2—苯基丙烯(
)的说法中正确的是( )
A.二者均可使溴水、高锰酸钾褪色,且褪色原理相同
B.2—苯基丙烯分子中所有碳原子一定共平面
C.二者可与足量的氢气在一定条件下反应得到同一种产物,此产物的一氯代物有5种
D.二者可以通过加成聚合反应形成高分子化合物
难度: 中等查看答案及解析
-
仅用下表提供的用品(夹持仪器和试剂任选)能实现相应实验目的的是( )
选项
实验目的
仪器
A
从食盐水中获得NaCl晶体
坩埚、玻璃棒、酒精灯、泥三角
B
除去氢氧化铝胶体中的泥沙
半透膜、烧杯、玻璃棒
C
用0.1000mol/L盐酸测定未知浓度的NaOH溶液浓度
碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯
D
中和热的测定
烧杯、温度计、环形玻璃搅拌棒、泡沫塑料、硬纸板
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
环己酮(
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
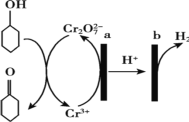
A.a 极与电源负极相连
B.a 极电极反应式是 2Cr3+- 6e- +14OH-= Cr2O72-+7H2O
C.b 极发生氧化反应
D.理论上生成 1mol 环己酮时,有 1molH2 生成
难度: 中等查看答案及解析
-
已知:p=p
=-lg
。室温下,向0.10mo1·L-1的HX溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH随p的变化关系如图。下列说法正确的是( )
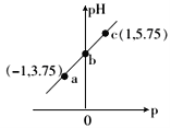
A.a点溶液中:c(HX)+c(X-)=0.10mo1·L-1
B.c点溶液中:c(Na+)<10c(HX)
C.b点坐标为(0,4.50)
D.溶液中水的电离程度:c<b<a
难度: 困难查看答案及解析
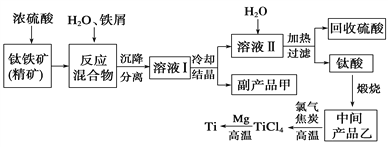

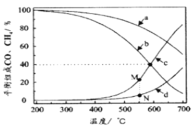
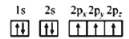 B.
B.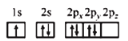
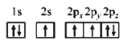 D.
D.