-
化学与人类社会生活密不可分,下列说法正确的是( )
A.用铝制器皿可长时间盛放酸性、碱性或咸的食物
B.用可溶性铝盐的溶液与过量氨水反应可制取Al(OH)3
C.用加热的方法可除去 NaHCO3固体中混有的少量Na2CO3
D.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液肯定是钠盐溶液
难度: 简单查看答案及解析
-
能贮存在带玻璃塞的无色玻璃试剂瓶中的试剂是( )
A.硫酸 B.烧碱溶液 C.硝酸银溶液 D.氢氟酸
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应制氢气时,下列措施能加快氢气生成速率的是( )
A.加入少许KNO3固体
B.加入Na2SO4溶液
C.滴入几滴CuSO4溶液
D.不用稀硫酸,改用98%浓硫酸
难度: 简单查看答案及解析
-
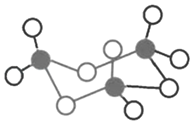
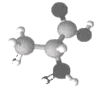
一种形状似牛的有机物分子,其结构简式如图所示。下列说法错误的是( )
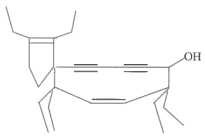
A.该物质能与金属钠反应
B.该物质可使溴水褪色
C.该物质可发生加聚反应
D.该物质与CH2=CHCH2OH互为同系物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24LSO3的分子数为0.1NA
B.0.1mol熔融的 NaHSO4中阳离子数为0.1NA
C.含0.1 molHCl的浓盐酸与过量MnO2充分反应,电子转移数为0.05NA
D.pH=3的HN3(一元弱酸)溶液,HN3的物质的量浓度为0.001mol•L﹣1
难度: 中等查看答案及解析
-
下列说法错误的是( )
A.植物油氢化可制得人造脂肪
B.C4H10的一氯代物最多有两种
C.乙烯可用做植物生长调节剂
D.向鸡蛋清溶液中加入饱和硫酸铵溶液,可使蛋白质发生盐析
难度: 简单查看答案及解析
-
下列实验的现象及有关反应方程式均正确的是( )
实验
现象
方程式
A
向10mL0.1mol•L﹣1NaOH溶液中加入10mLFeCl3饱和溶液
溶液变红褐色
Fe3++3OH﹣=Fe(OH)3(胶体)
B
将丙烯通入溴的四氯化碳溶液
红棕色褪去
CH3CH=CH2+Br2→BrCH2CH=CH2+HBr
C
FeCl2溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
3Fe2++2[Fe(CN)6]3﹣=Fe3[Fe(CN)6]2↓
D
SO2通入Ba(NO3)2溶液中
产生白色沉淀
H2O+SO2+Ba2+=BaSO3↓+2H+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示,下列说法错误的是( )

A.配制400mL上述溶液可选用500mL容量瓶
B.该注射液中葡萄糖的物质的量浓度为0.01mol•L﹣1
C.该注射液为一种分散系,但不能产生丁达尔现象
D.可用新制氢氧化铜悬浊液检验人体尿液中是否含有葡萄糖
难度: 中等查看答案及解析
-
煤和石油是重要的能源及化工原料,下列说法错误的是( )
A.煤经过干馏可得到苯、甲苯等芳香族化合物
B.煤通过间接液化可合成甲醇
C.石油分馏得到汽油、煤油等产品的过程是化学变化
D.石油裂解可得到乙烯、丙烯等重要化工原料
难度: 简单查看答案及解析
-
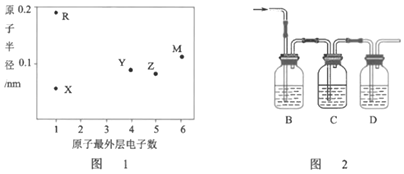
2019年为门捷列夫发现元素周期律150周年。门捷列夫曾经成功预言了元素Q的存在和性质。X、Y、Z、M为四种短周期元素,它们在周期表中的位置如表。Y的最高价氧化物对应水化物既可与强酸又可与强碱反应。下列说法错误的是( )
X
Y
Z
M
Q
A.气态氢化物的稳定性:Z>X
B.Q的单质可作为半导体材料
C.M与Q可形成化合物QM4
D.电解Y和X形成的某种化合物可制取单质Y
难度: 中等查看答案及解析
-
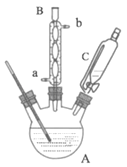
下列操作能达到实验目的是( )
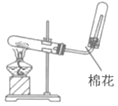
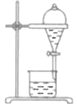
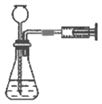
A.蒸干FeCl3溶液制备FeCl3晶体
B.用NH4Cl分解制备NH3
C.分离苯和溴苯
D.推动活塞后松开,可检验装置的气密性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列示意图对应的化学用语表述错误的是( )
A
结构简式
B
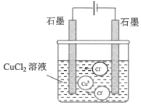
电解氯化铜溶液
CuCl2
Cu2++2Cl﹣
C
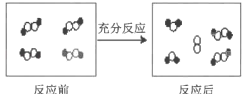
化学方程式为
2H2O⇌2H2O+O2↑
D
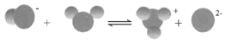
HS﹣在水中的电离
HS﹣+H2O⇌H3O++S2﹣
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
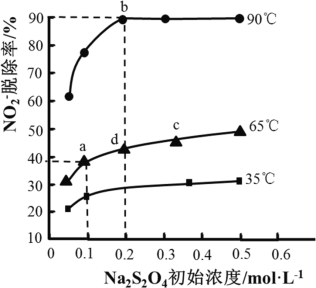
已知t℃时,某些物质的平衡常数K的值如表所示,下列说法错误的是( )
物质
HCIO
H2CO3
AgCl
AgI
平衡常数
Ka≈10﹣9
K≈10﹣7
K≈10﹣11
Ksp≈1.8×10﹣10
Ksp≈8.51×10﹣17
A.向新制氯水中加入少量NaHCO3增强氯水漂白性
B.相同温度和浓度下,NaClO溶液的pH比Na2CO3溶液的pH小
C.t℃时,AgCl(s)+I﹣(aq)
AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
D.将AgCl和AgI的饱和溶液等体积混合,再加入足量AgNO3溶液,会生成等量的AgCl和AgI沉淀
难度: 中等查看答案及解析
-
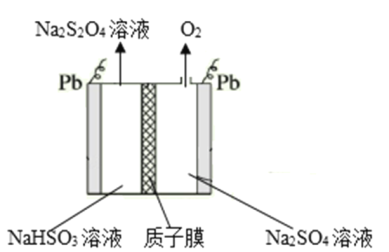
华为研发人员利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1﹣xCoO2C6+LiCoO2,其主要优势在于使用寿命长和充电速度快,其工作原理如图所示。下列关于该电池的说法错误的是( )
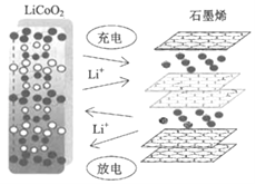
A.该电池若用隔膜,可选用阳离子交换膜
B.充电时,阴极反应为C6+xLi++xe﹣=LixC6
C.放电时,LiCoO2极发生的电极反应为:LiCoO2﹣xe﹣=Li1﹣xCoO2+xLi+
D.废旧的该电池进行“放电处理”,让Li+嵌入 LiCoO2中有利于回收石墨烯
难度: 中等查看答案及解析
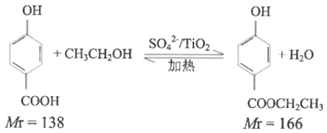
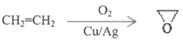 ,根据上述流程,以ClCH2CH=CH2和对甲基苯酚为原料制备
,根据上述流程,以ClCH2CH=CH2和对甲基苯酚为原料制备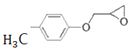 ,写出合成路线_____(无机试剂任选)。
,写出合成路线_____(无机试剂任选)。