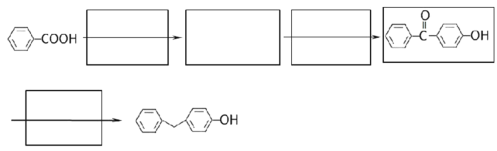
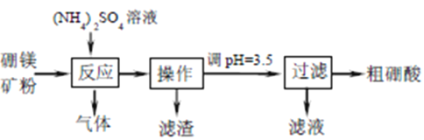
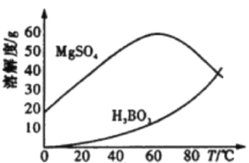
-
下列说法正确的是( )
A.五彩缤纷的烟花利用了焰色反应,焰色反应是常见的化学反应
B.泡沫灭火器灭火是利用了A12(SO4)3和小苏打的反应
C.Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2
D.实验室可用氧化铝坩埚熔化NaOH、Na2CO3固体
难度: 中等查看答案及解析
-
目前我国城市正在实行垃圾分类处理,保鲜膜(聚乙烯)、含汞干电池分别属于下列哪类垃圾
A.其他垃圾、厨余垃圾 B.厨余垃圾、可回收垃圾
C.有害垃圾、其他垃圾 D.可回收垃圾、有害垃圾
难度: 简单查看答案及解析
-
下列对化学用语的理解正确的是
A.中子数为8的氮原子:
B.电子式
可以表示氢氧根离子,也可以表示羟基
C.聚丙烯的结构简式:
D.结构示意图
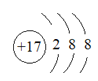 可以表示
可以表示,也可以表示
难度: 简单查看答案及解析
-
下列解释事实的离子方程式正确的是
A.向NaClO溶液中通入少量CO2制取次氯酸:ClO-+H2O+CO2=HClO+HCO3-
B.电解MgCl2溶液:2H2O+2Cl-
2OH-+H2↑+Cl2↑
C.Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-=Fe3++NO↑+2H2O
难度: 中等查看答案及解析
-
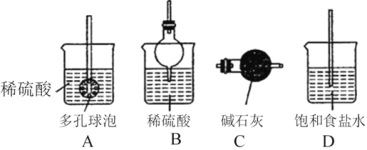
下列有关实验能达到相应实验目的的是
A.证明HNO3的酸性强于H2SO3
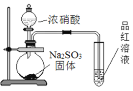 B.制备干燥的氨气
B.制备干燥的氨气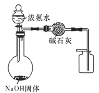
C.验证石蜡油发生了裂化反应
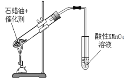 D.制备乙酸乙酯
D.制备乙酸乙酯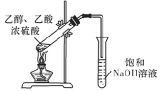
难度: 中等查看答案及解析
-
下表中物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的一组是
选项
物质(括号为少量杂质)
除杂方法
A
CO2(SO2)
通入饱和碳酸氢钠溶液,再通入碱石灰干燥
B
KNO3(NaCl)
溶于水配成热饱和溶液,冷却结晶
C
FeCl2(Fe)
通入少量氯气加热
D
Cu(CuO)
空气中加热
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.1molAl分别与足量的稀硫酸和稀硝酸反应转移电子数均为3NA
B.0.1molN4S4(结构如图所示)含有NA个S—N键
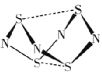
C.标准状况下,1mol甲基(—14CD3)所含的中子数为10NA
D.1molCH3COOC2H5在稀硫酸中水解可得到的乙醇分子数为NA
难度: 中等查看答案及解析
-
利用Al-PMOF可快速将芥子气降解为无毒物质,其结构如图。其中X、Y、Z为短周期元素且原子序数依次增大,X、Y同主族。下列说法正确的是
A.原子半径:Z>Y>X
B.YXZ2中Y的化合价为+5
C.含氧酸酸性:Z>Y
D.同浓度氢化物水溶液酸性:Z>Y>X
难度: 困难查看答案及解析
-
室温下,利用如图所示,可回收酸性废水中低浓度的铜,下列说法错误的是
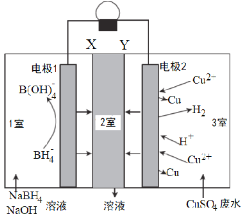
A.电极2为正极,只发生反应:Cu2++2e—=Cu
B.Y为阴离子交换膜,2室流出的溶液是Na2SO4溶液
C.每8molNaOH参加反应,有8mol电子转移
D.此装置在回收铜的同时还有电流产生
难度: 中等查看答案及解析
-
Weiss利用光敏剂QD制备2-环己基苯乙烯(c)的过程如图所示,下列有关说法正确
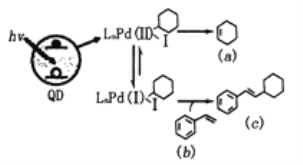
A.a中所有碳原子都在同一个平面上 B.b既能发生氧化反应也能发生还原反应
C.b有共轭双键,能发生1,4-加成 D.b、c是同系物
难度: 简单查看答案及解析
-
科学工作者研发了一种SUNCaT的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法不正确的是
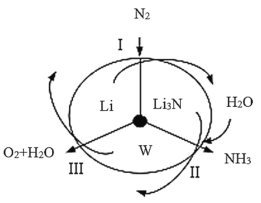
A.过程Ⅰ的产物只有一种
B.W是LiOH
C.过程Ⅲ的反应是4LiOH=4Li+2H2O+O2↑
D.此循环过程中Li被消耗掉了
难度: 简单查看答案及解析
-
298K、25℃,在NaHS溶液中,各离子的浓度随NaHS溶液浓度的变化关系如图所示,下列叙述不正确的是
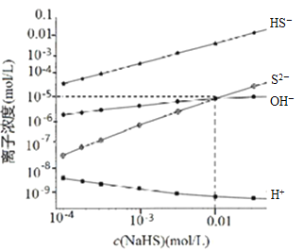
已知:298K(25℃)H2S的Ka1=9.10×10-8,Ka2=1.10×10-12。
A.0.10mol/LNaHS溶液:c(Na+)>c(HS−)>c(S2−)>c(OH−)>c(H+)
B.Na2S溶液中:c(Na+)=2c(S2−)+2c(HS−)+2c(H2S)
C.随着c(NaHS)浓度的增大c(H+)也将持续增大
D.当c(OH−)=c(S2−)时,c(H+)=10-9mol/L
难度: 简单查看答案及解析
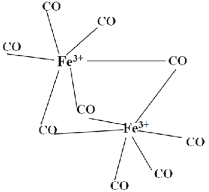
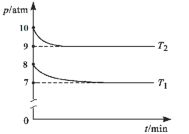
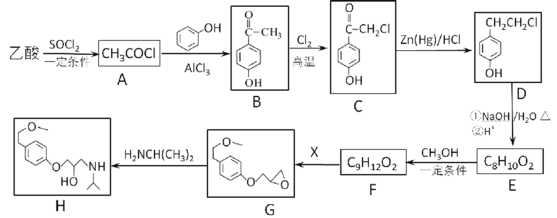
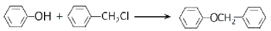 +HCl
+HCl