-
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y是短周期元素中原子半径最大的原子,X、Y、Z的简单离子电子层结构相同,Z与W最外层电子数之和等于10。下列说法正确的是
A. 最高正价由低到高的顺序为: Y、Z、X、W
B. 原子半径由小到大的顺序为:X、Z、W
C. Y、Z、W的最高价氧化物的水化物两两之间均能发生反应
D. X与Y两种元素只能组成一种化合物
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系正确的是( )
化学性质
实际应用
A
SiO2是酸性氧化物
生产光导纤维
B
Fe2(SO2)3易水解
脱除天然气中H2S
C
乙烯能发生加聚反应
用作水果的催熟剂
D
NH3具有还原性
将柴油车尾气中NO转化为N2
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列关于双黄连口服液中的活性成分绿原酸(结构筒式如下图)的说法不正确的是( )
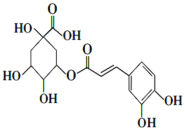
A.分子式为C16H16O9 B.能与NaHCO3溶液反应生成CO2
C.不能发生水解反应 D.能与酸性KMnO4溶液反应
难度: 中等查看答案及解析
-
下列实验设计能达到相应实验目的的是( )
A.提纯含少量乙酸的乙酸乙酯:用饱和Na2CO3溶液洗涤、分液
B.制备Fe(OH)3胶体:将FeCl3溶液加入稀氨水中并加热煮沸
C.制取并纯化SO2:将Na2SO3与浓盐酸混合产生的气体通过浓硫酸
D.测定“84”消毒液的pH:用洁净的玻璃棒蘸取少许“84”消毒液滴在pH试纸上
难度: 中等查看答案及解析
-
酸性重铬酸盐溶液中加入乙醚和H2O2发生反应
+4H2O2+2H+=2CrO(O2)2+5H2O。上层出现蓝色,一段时间后上层蓝色逐渐褪去且水相变为绿色(Cr3+)。下列说法错误的是( )
A.溶液出现蓝色的反应属于非氧化还原反应
B.乙醚可用乙醇代替
C.该方法既可用于检验H2O2,又可用于检验
D.水层逐渐变为绿色发生的离子反应为4CrO(O2)2+ 12H+=4Cr3++ 6H2O+7O2↑
难度: 中等查看答案及解析
-
方铅矿(PbS)与黄铁矿(FeS2)两矿法酸溶铅的示意图如下,下列说法错误的是( )
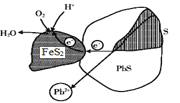
A.PbS上的电势比FeS2上的低
B.浸取液的pH随反应的进行逐渐增大
C.PbS表面发生的反应为PbS-2e-=Pb2++ S
D.FeS2表面发生的反应为FeS2+2e-=Fe2++ 2S2-
难度: 中等查看答案及解析
-
25℃时,用 0.100 mol /L 盐酸滴定 20.00 mL 0.100 mol/L的CH3COONH4溶液,滴定曲线如下图所示,下列说法正确的是( )
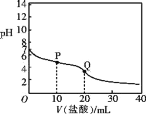
A.可用酚酞作滴定指示剂
B.滴定过程中水的电离程度不断增大
C.P点溶液中:2c(
)<3c(CH3COO-)+c(CH3COOH)
D.Q点溶液中:c(Cl-)>c(
)>c(CH3COO-)>c(H+)
难度: 中等查看答案及解析
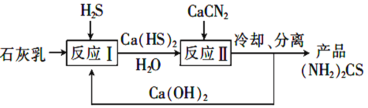
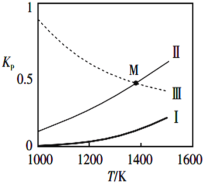
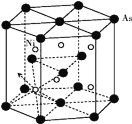
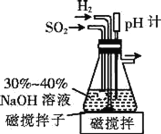
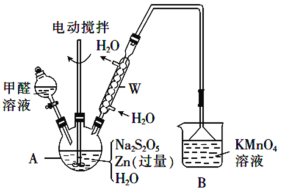
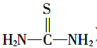 )是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
)是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题: