-
常见的电子气体有BCl3、N2O、SiH4及SiHCl3等。回答下列问题:
(1)气体B2H6与氯气混合可生成气态BCl3,每生成1.0 g BCl3放出5.9 kJ的热量,该反应的热化学方程式为______。
(2)25℃时反应 S(s) +H2(g)⇌H2S(g) Kp1=6.0×105
Si(s)+2H2(g)⇌SiH4(g) Kp2=7.8×106
则反应 Si(s)+2H2S(g)⇌SiH4(g)+2S(s) Kp=_____(Kp为以分压表示的平衡常数,下同)。
(3)多晶硅制中发生一系列反应:
(I)4SiHCl3(g)⇌Si(s)+3SiCl4(g)+2H2(g) △H1=a kJ /mol
(II)SiCl4(g)+H2(g)⇌SiHCl3(g)+HCl(g) △H2=b kJ/mo1
(III)SiCl2(g)+H2(g)⇌Si(s)+2HCl(g) △H3=c kJ/mo1
①反应SiHCl3 (g)⇌SiCl2 (g) +HCl (g) △H=____kJ/mo1 (用含a、b、c的代数式表示)
②反应(I)(II)(III)的Kp与温度的关系如下图
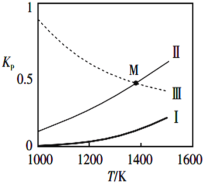
属于吸热反应的是_________(填I、II或III);图中M点分压间满足关系:p(SiCl4)=______(用相关物质的分压p表示)。
(4)一种制取N2O的方法为 O2NNH2(aq)→N2O(g)+H2O(1),该反应的历程如下:
(I)O2NNH2(aq) O2NNH-(aq) +H+(aq) (快速平衡)
O2NNH-(aq) +H+(aq) (快速平衡)
(II)O2NNH-(aq) N2O(g) +OH-(aq) (慢)
N2O(g) +OH-(aq) (慢)
(III)H+(aq)+OH-(aq) H2O(1) (快)
H2O(1) (快)
①活化能最大的反应步骤是_________(填I、II或III)。
②已知反应(I)的速率方程v(正)=k1c(O2NNH2),v(逆)=k -1 c(O2NNH-)•c(H+),(k1、k -1分别为正逆反应速率常数,反应(I)达到平衡时,平衡常数K=__________(用k1、k -1表示)。
③已知总反应速率方程为v=K ,反应(II)的v(正)=k2c(O2NNH-),则K=________ (用k1、k -1、k2、k3表示)
,反应(II)的v(正)=k2c(O2NNH-),则K=________ (用k1、k -1、k2、k3表示)
-
氨气与适量氯气混合反应可生成NH4Cl(俗称脑砂)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。
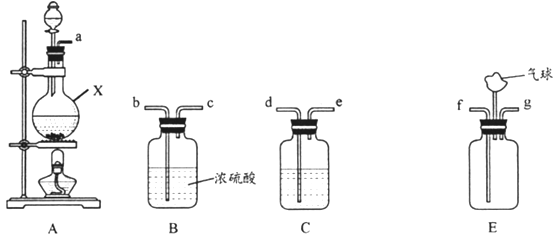
(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为____;X中发生反应的离子方程式为_______。
(2)要得到干燥纯净的氯气,上述A、B、C装置的连接顺序依次为a→_____(用小写字母表示)。
(3)利用E装置,将适量氨气与氯气充分混合反应氨气应从_______(用小写字母表示)通入,反应的化学方程式为_______________;可能观察到的现象是___________。
(4)《唐本草》记载脑砂入药可以散瘀消肿,天然脑砂含少量NH4Cl,现取天然脑砂进行NH4Cl含量测定。准确称取一定质量脑砂,与足量的氧化铜混合,如下图所示进行实验。已知:2NH4Cl+3CuO=3Cu+N2+2HCl+3H2O 。

①为顺利完成有关物理量的测定,请完善下列表格:
| 测量时间点 | 加热前 | 当观察到_____现象时 |
| 测量内容 | _______________ | 停止加热,冷却,称量H装置的总质量 |
②如果不用J装置,测出NH4Cl的含量将_____(填“偏高”“偏低”或“无影响”)。
-
氨气与适量氯气混合反应可生成NH4Cl(岩脑砂的主要成分)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。
A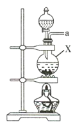 B
B
C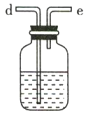 D
D
(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为 ________________ 。
(2)要得到干燥纯净的氯气,A、B、C装置中导管的连接顺序为a→ ________________ → ________________ → ________________ → ________________ 。
(3)利用D装置,将适量氨气与氯气充分混合,氨气应从__________ 通入,反应的化学方程式为 ___________;可能观察到的现象是________________。
(4)现取岩脑砂进行NH4Cl含量的测定。准确称取一定质量的岩脑砂,与足量的氧化铜混合,如图所示进行实验。已知:2NH4Cl+3CuO 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O

①为顺利完成有关物理量的测定,请完善下列表格。
| 测量时间点 | 反应前 | 反应后 |
| 测量内容 | ________________ | 当观察到 ________________ 现象时停止加热,冷却,称量H装置的总质量 |
②如果不用H装置,测出NH4Cl的含量将 _____ (填“偏高”“偏低”或“无影响”)。
-
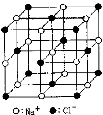
用N0表示阿伏加德罗 常数的值,下列说法中不正确的是
常数的值,下列说法中不正确的是
A.将氯气通入足量氢氧化钠溶液中,当消耗4nmolNaOH时,反应中转移的电子为4nN0
B.4.4g由N2O和CO2组成的混合气体含0.3N0个原子
C.23.4gNaCl晶体中含0.1N0个右图所示的结构单元
D.7.8gNa2O2与足量潮湿的CO2反应,转移的电子数为0.1N0
-
N2O俗名为“笑气”,也是一种温室气体。结合所学知识,回答下列问题:
(1)锌与极稀硝酸反应可生成N2O,该反应的化学方程式为___________,其中作氧化剂的硝酸与参与反应的硝酸的物质的量之比为___________。
(2)已知几种物质的相对能量如下:
| 物质 | N2O(g) | CO(g) | N2(g) | CO2(g) |
| 相对能量/kJ∙mol-1 | 475.5 | 283.0 | 393.5 | 0 |
①N2O(g)和CO(g)反应生成N2(g)和CO2(g)的热化学方程式为____________。
②若其他条件不变,加入高效催化剂,该反应的焓变将_______(填“增大”、“减小”或“不变”)。
(3)碘蒸气能催化N2O的分解,反应历程(步骤)如下:
i.I2(g)⇌2I(g)
ii.I(g)+N2O(g)=N2(g)+IO(g)
iii.2IO(g)+2N2O(g)=2N2(g)+2O2(g)+I2(g)
实验表明,在反应过程c(I)始终大于c(IO),由此推测,反应速率ii_________iii(填“>”、“<”或“=”)。
(4)一定温度下,向恒容密闭容器中充入2 mol N2O(g)和3 mol NO(g),发生反应:N2O(g)+NO(g)⇌N2(g)+NO2(g) △H。测得N2体积分数与温度、时间的关系如图所示。
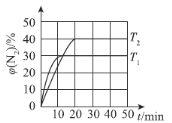
①△H___________0(填“>”、“<”或“=”)。
②下列情况表明该反应达到平衡状态的是___________(填字母)。
A.混合气体的密度不再改变 B.相对分子质量不再改变
C.NO和NO2的消耗速率相等 D.N2O的体积分数不再改变
③T1时,该反应的平衡常数K=___________。
-
由ⅢA、VA族元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。与BCl3互为等电子体,且由第二周期元素组成的一种阴离子为__________(填离子符号)。
(2)氨硼烷(H3N—BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料。
①H3N—BH3中N 原子的轨道杂化类型为________________。
②Ti(BH4)3由TiCl3和LiBH4反应制得。基态Ti3+的未成对电子数为____________;BH4-的立体构型
是_______;该制备反应的化学方程式为______________ 。
(3)氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:
3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
下列有关叙述错误的是_____________
A.氨硼烷中存在配位键
B.第一电离能大小关系:N>O>C>B>H
C.反应前后碳原子的杂化类型不变
D.CH4、H2O、CO2分子空间构型分别是:正四面体型、V型、直线型
(3) GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为_____________。Ga的配位原子(As)数目为________;Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGa cm和rAscm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为__________。
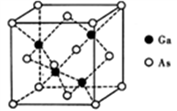
-
甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)= SiCl4(g)+2H2(g) ∆H=-241 kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) ∆H=-31 kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是____________________________。
(2)工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________。
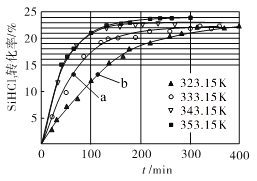
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g)  SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
① 353.15 K时,平衡转化率为_________,反应的平衡常数K=________(保留3位小数)。该反应是________反应(填“放热”“吸热”)。
②323.15 K时,要缩短反应达到平衡的时间,可采取的措施有_________、__________。
③ 比较a、b处反应速率的大小:va_____vb (填“>”“<”或“=”)。已知反应速率v正= ,v逆=
,v逆= ,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15 K时
,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15 K时 =________(保留3位小数)。
=________(保留3位小数)。
-
甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)= SiCl4(g)+2H2(g) ∆H=-241 kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) ∆H=-31 kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是____________________________。
(2)工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________。
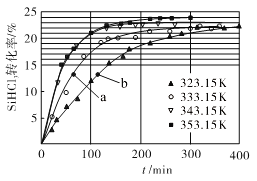
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g)  SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
① 353.15 K时,平衡转化率为_________,反应的平衡常数K=________(保留3位小数)。该反应是________反应(填“放热”“吸热”)。
②323.15 K时,要缩短反应达到平衡的时间,可采取的措施有_________、__________。
③ 比较a、b处反应速率的大小:va_____vb (填“>”“<”或“=”)。已知反应速率v正= ,v逆=
,v逆= ,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15 K时
,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15 K时 =________(保留3位小数)。
=________(保留3位小数)。
-
甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)=SiCl4(g)+2H2(g) ∆H=-241kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) ∆H=-31kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是 ___。
(2)铝锂形成化合物LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,请写出其水解反应化学方程式____。LiAlH4在化学反应中通常作_______(填“氧化”或“还原”)剂。工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为 _________
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g) SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
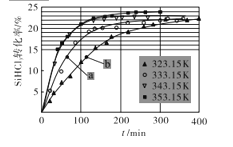
①353.15K时,平衡转化率为____,该反应是____反应(填“放热”“吸热”)。
②323.15K时,要缩短反应达到平衡的时间,可采取的最佳措施是____。
(4)比较a、b处反应速率的大小:Va ___Vb (填“>”“<”或“=”)。已知反应速率V正=K1x2SiHCl3,V逆=K2xSiH2Cl2xSiCl4,K1,K2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时K1/K2 =____(保留3位小数)。
(5)硅元素最高价氧化物对应的水化物是H2SiO3,室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是 ___,其原因是____。已知:H2SiO3 :Ka1=2.0×10-10、Ka2=2.0×10-12、H2CO3 :Ka1=4.3×10-7,Ka2=5.6×10-11
-
硼及其化合物在耐高温合金工业、催化剂制造、高能燃料等方面有广泛应用。
(1)硼原子的价电子排布图为____________。
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为________。
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B__________N(填“>”“<”或“=”,下同)。H2N―→BH2中B原子的杂化类型为________。
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是________;写出制备反应的化学方程式:____________。
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。
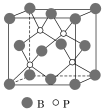
①磷化硼晶体属于______________晶体(填晶体类型),____________(填“是”或“否”)含有配位键。
②晶体中P原子的配位数为____________。
③已知BP的晶胞边长为a nm,NA为阿伏加德罗常数的数值,则磷化硼晶体的密度为____________g·cm-3(用含a、NA的式子表示)。

O2NNH-(aq) +H+(aq) (快速平衡)
N2O(g) +OH-(aq) (慢)
H2O(1) (快)
,反应(II)的v(正)=k2c(O2NNH-),则K=________ (用k1、k -1、k2、k3表示)


 B
B
 D
D







