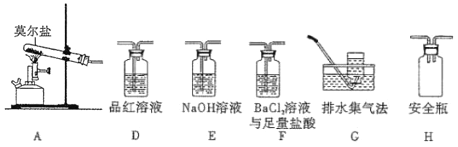
-
化学与生产、生活密切相关。下列有关叙述正确的是
A. “一带一路”被誉为现代丝绸之路,丝绸属于纤维素
B. 电解水制氢气可缓解能源危机,实现节能环保
C. “雨后彩虹”是一种与胶体有关的自然现象
D. 烧制“明如镜、声如磬”的瓷器时未涉及化学变化
难度: 简单查看答案及解析
-
碳纳米管、石墨烯、C60等新型碳材料具有广阔的应用前景。下列说法正确的是

A. 碳纳米管属于胶体
B. 石墨烯属于有机化合物
C. C60与金刚石互为同素异形体
D. 均具有相同的熔点
难度: 中等查看答案及解析
-
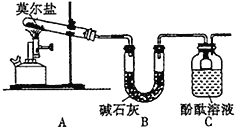
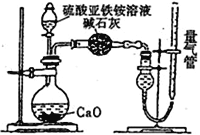
水合肼(N2H4·H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,其制备的反应原理为NaClO+2NH3===N2H4·H2O+NaCl。下列关于实验室制备水合肼的操作不正确的是( )
甲
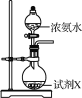 乙
乙丙
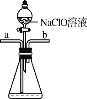 丁
丁A. 装置甲中试剂X可以选择生石灰 B. 装置乙作为反应过程的安全瓶
C. 装置丙制备水合肼时氨气从b口进入 D. 装置丁可用于吸收多余的尾气
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,124gP4中所含P—P键数目为4NA
B.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
C.17g甲基(—14CH3)所含的电子数目为10NA
D.1.5molFeI2与22.4LCl2完全反应时转移的电子数为2NA
难度: 中等查看答案及解析
-
常温,下列各组离子一定能在指定溶液中大量共存的是( )
A.
=10-12的溶液中:
、Cu2+、
、
B.滴加KSCN溶液显红色的溶液中:
、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、
难度: 简单查看答案及解析
-
为除去括号内的杂质,下列操作或试剂的选择不合理的是
选项
被提纯的物质
除杂试剂
分离方法
A
Br2(CCl4)
/
蒸馏
B
CuO(Cu)
/
空气中灼烧
C
Cl2(HCl)
饱和食盐水
洗气
D
CH4(CH2=CH2)
酸性高锰酸钾溶液
洗气
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水
NaClO3
NaClO4
NaClO4
 NH4ClO4
NH4ClO4下列说法错误的是
A.NH4ClO4属于离子化合物
B.溶解度:NaClO4>NH4ClO4
C.电解NaClO3溶液时阳极反应式为ClO3-+H2O-2e-=C1O4-+2H+
D.该流程中可循环利用的物质是NH4Cl
难度: 中等查看答案及解析
-
有关下列四个常用电化学装置的叙述中,正确的是
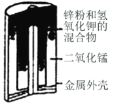
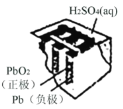


图I碱性锌锰电池
图II铅-硫酸蓄电池
图III电解精炼铜
图IV银锌纽扣电池
A.图Ⅰ所示电池中,正极的电极反应式为Zn-2e+2OH-=Zn(OH)2
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池工作过程中,电子由Zn极沿导线流向Ag2O极
难度: 中等查看答案及解析
-
1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是( )

A. P4(s,白磷)=4P(s,红磷) ΔH>0
B. 以上变化中,白磷和红磷所需活化能相等
C. 白磷比红磷稳定
D. 红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ/mol
难度: 困难查看答案及解析
-
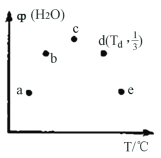
第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是
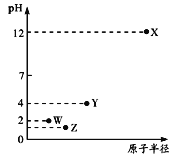
A. 简单离子半径: X>Y>Z>W
B. W的单质在常温下是黄绿色气体
C. 气态氢化物的稳定性: Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液中的微粒共有2种
难度: 中等查看答案及解析
-
C是一种常见的工业原料,实验室制备C的化学方程式如下,下列说法正确的( )
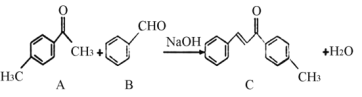
A.l mol的C最多能与7 mol的H2反应
B.分子C中所有碳原子一定共平面
C.可以用酸性KMnO4溶液鉴别A和B
D.A的同分异构体中含有苯环和醛基的结构有14种
难度: 中等查看答案及解析
-
2019年10月9日诺贝尔化学奖授予在锂离子电池方向研究有突出贡献的三位科学家。LiFePO4电池是新能源汽车关键部件之一,其工作原理如图所示,其中有电极反应为xLi-xe-=xLi+。下列说法错误的是
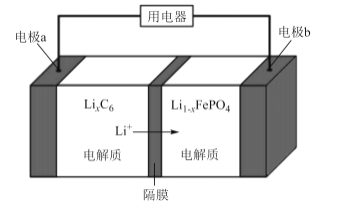
A.充电时,电极a与电源的负极连接,电极b与电源正极连接
B.电池驱动汽车前进时,正极的电极反应为:Li1-xFePO4+xLi++xe-=LiFePO4
C.电池驱动汽车后退时,负极材料减重1.4g,转移0.4mol电子
D.电池进水将会大大降低其使用寿命
难度: 中等查看答案及解析
-
图1为CO2与CH4转化为CH3COOH的反应历程(中间体的能量关系如虚框中曲线所示),图2为室温下某溶液中CH3COOH和CH3COO-两种微粒浓度随pH变化的曲线。下列结论错误的是

A.CH4分子在催化剂表面会断开C—H键,断键会吸收能量
B.中间体①的能量大于中间体②的能量
C.室温下,CH3COOH的电离常数Ka=10-4.76
D.升高温度,图2中两条曲线交点会向pH增大方向移动
难度: 困难查看答案及解析
-
将质量为32g的铜与150mL的一定浓度的硝酸反应,铜完全溶解,产生标准状况下11.2L的NO和NO2的混合气体,将生成的混合气体与一定体积的氧气一起通入足量NaOH溶液中,气体恰好被吸收生成NaNO3。下列说法不正确的是
A.标准状况下,通入的O2体积为5.6L
B.向反应后的溶液加NaOH,使铜沉淀完全,需要NaOH的物质的量至少为1.0mol
C.标准状况下,混合气体构成是5.6L的NO和5.6L的NO2
D.硝酸的物质的量浓度为10.0mol·L−1
难度: 困难查看答案及解析