-
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
A.甲醇 B.天然气 C.液化石油气 D.氢气
难度: 简单查看答案及解析
-
已知化学反应A2(g) + B2(g) =2AB(g)的能量变化如图所示,
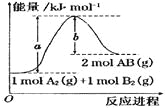
下列叙述中正确的是
A.该反应热△H=+(a-b)kJ/mol
B.缩小体积增大压强,A的物质的量浓度不变
C.该反应为放热反应
D.加入催化剂可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析
-
下列各组离子在常温下一定能大量共存的是
A.在0.1mol·L-1FeCl3溶液中:K+、Na+、I-、SCN-
B.在
=1012的溶液中:Al3+、
、K+、Cl-
C.1.0mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、
D.水电离出来的c(H+)=10-12mol/L的溶液:K+、
、Cl-、ClO-
难度: 中等查看答案及解析
-
对于反应C(s)+H2O(g)⇌CO(g)+H2(g);△H>0,下列有关说法正确的是
A.升高体系温度,平衡常数K减小
B.增大体系压强,平衡常数K不发生变化
C.平衡常数表达式为K=
D.增加C(s)的量,平衡正向移动
难度: 简单查看答案及解析
-
电子表和电子计算器的电源通常用微型银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+H2O+Zn===Zn(OH)2+2Ag。下列说法正确的是
A.Ag2O是正极,Zn是负极
B.Zn是正极,Ag2O是负极
C.工作时,电池负极区溶液pH增大
D.工作时,电子由Ag2O极经外电路流向Zn极
难度: 简单查看答案及解析
-
如图是可逆反应
在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )

A.t1时,反应只向正方向进行 B.t2时,反应未达到限度
C.t2~t3,反应已停止 D.t2~t3,各物质的浓度不再发生变化
难度: 中等查看答案及解析
-
关于小苏打水溶液的表述正确的是
A.存在的电离平衡为
+H2O
H2CO3+OH-
B.c(Na+)+c(H+)=c(
)+c(
)+c(OH-)
C.
的电离程度大于
的水解程度
D.c(Na+)=c(
)+c(
)+c(H2CO3)
难度: 简单查看答案及解析
-
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是
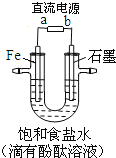
A.a 为电源的正极
B.通电一段时间后,石墨电极附近溶液先变红
C.Fe电极的电极反应是4OH-- 4e-=2H2O+O2↑
D.电解饱和食盐水的总反应是:
难度: 中等查看答案及解析
-
向三份0.1mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
难度: 中等查看答案及解析
-
在容积不变的密闭容器中存在如下反应:2A(g)+B(g)
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
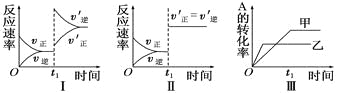
A.图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D.图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.CH3Cl(g)+Cl2(g)
CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
B.室温下,稀释0.1mol·L-1NH4Cl溶液,溶液中
增大
C.向稀氨水中加入少量氯化铵固体,一水合氨的电离程度增大
D.向硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,向沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
难度: 困难查看答案及解析
-
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
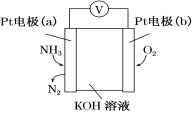
A.O2在电极b上发生还原反应
B.溶液中OH-向电极a移动
C.反应消耗的NH3与O2的物质的量之比为4∶5
D.负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
难度: 中等查看答案及解析
-
四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
①TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)ΔH1=+175.4kJ·mol-1
②C(s)+
O2(g)=CO(g)ΔH2=-110.45kJ·mol-1
下列说法正确的是
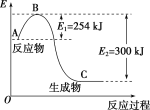
A.C的燃烧热是-110.45kJ·mol-1
B.若反应①中使用催化剂加快反应速率,单位时间内吸收更多热量,则ΔH1变大
C.反应①中的能量变化如图所示
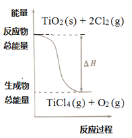
D.反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)ΔH=-45.5kJ·mol-1
难度: 中等查看答案及解析
-
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生反应:PCl3(g)+Cl2(g)
PCl5(g),并于10min时达到平衡。有关数据如下:
PCl3(g)
Cl2(g)
PCl5(g)
初始浓度(mol·L-1)
2.0
1.0
0
平衡浓度(mol·L-1)
c1
c2
0.4
下列判断不正确的是
A.10min内,v(Cl2)=0.04mol·L-1·min-1
B.当容器中Cl2为1.2mol时,反应达到平衡
C.升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的
<1
D.平衡后移走2.0molPCl3和1.0molCl2,相同条件下再次平衡,c(PCl5)<0.2mol·L-1
难度: 中等查看答案及解析