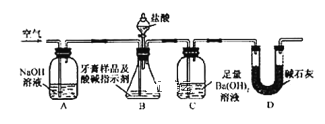
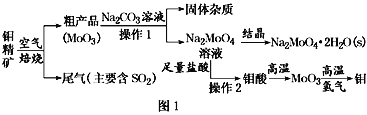
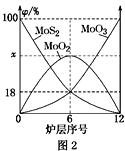
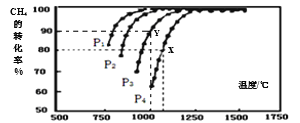
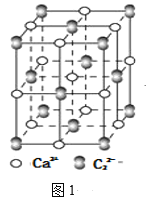
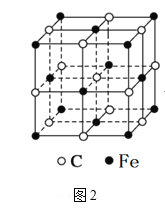
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1mol白磷(P4)和1mol甲烷中所含的共价键数均为4NA
B.标准状况下,22.4LCl2通入足量的NaOH溶液中,转移的电子数为NA
C.常温下,1L0.1mol·L-1NH4NO3溶液中所含的氢原子数为4NA
D.25℃时,0.5mol·L-1Na2S溶液中含有的阴离子数大于0.5NA
难度: 中等查看答案及解析
-
化学与生产、生活、材料密切相关,下列说法正确的是
A.食品工业以植物油和氢气为原料生产氢化植物油,发生了取代反应
B.向鸡蛋清中加入饱和(NH4)2SO4溶液有沉淀析出,加水后沉淀溶解
C.北斗导航卫星使用的太阳能电池板是将电能转化为化学能
D.聚乙烯、聚氯乙烯都是高分子化合物,属于纯净物
难度: 简单查看答案及解析
-
下列各组离子中,能大量共存且加入(或通入)X试剂后发生反应的离子方程式对应正确的是
选项
离子组
试剂X
离子方程式
A
Fe3+、Al3+、
、
过量的盐酸
+2H+═H2O+SO2↑
B
透明溶液中:Fe3+、
、
、Cl-
过量的铜粉
2Fe3++Cu═2Fe2++Cu2+
C
Na+、Ba2+、
、Cl-
NaHSO4溶液
H++
═CO2↑+H2O
D
pH=1的溶液中:Mg2+、Fe2+、
、
双氧水
2Fe2++H2O2+2H+═2Fe3++2H2O
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
关于化合物二苯基甲烷(
),下列说法正确的是( )
A.分子式C13H14 B.是苯的同系物
C.其一氯代物有4种 D.所有碳原子一定共平面
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大。W的某种核素不含中子;X、Y原子核外L层的电子数之比为3︰4;X与Z同主族,且X、Y、Z原子的最外层电子数之和为16。下列说法不正确的是( )
A.W、X、Z三种元素形成的化合物一定为强电解质
B.简单氢化物的稳定性:X>Z>Y
C.X分别可与W、Z各形成两种常见化合物
D.原子半径:Y>Z>X>W
难度: 中等查看答案及解析
-
氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )
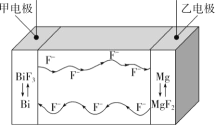
A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
难度: 简单查看答案及解析
-
水的电离平衡曲线如图所示,下列说法中,正确的是
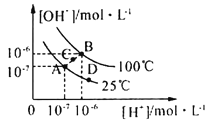
A.图中A、B、D三点处Kw的大小关系:B>A>D
B.25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
难度: 中等查看答案及解析