-
纵观古今,化学与生活皆有着密切联系。下列说法正确的是( )
A.《本草图经》在绿矾项记载:“盖此矾色绿,味酸,烧之则赤……”。因为绿矾能电离出H+,所以“味酸”
B.“司南之杓(勺),投之于地,其柢(勺柄)指南”,司南中“杓”的材质为Fe2O3
C.用盐酸能鉴别纯碱和食盐,只用蒸馏水不能。
D.东汉魏伯阳在《周易参同契》中对汞的描述:“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的“黄芽”是指硫黄
难度: 中等查看答案及解析
-
已知
表示阿伏加德罗常数的值,下列有关说法正确的是( )
A.1 mol CnH2n(n≥2)中所含的共用电子对数为(3n+1)NA
B.在12.0 g NaHSO4 和MgSO4混合物中,所含离子数目为0.2NA
C.1 L 1 mol·L-1饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶粒数为NA
D.标准状况下8.96 L D2含有中子数0.4NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.CH4和C15H32为同系物
B.分子式为C4H8BrCl的有机物共有11种(不含立体异构)
C.化合物
(b)、
(d)、正戊烷(p)中只有b的所有碳原子可能处于同一平面
D.CH3CH=CHCH3分子中的四个碳原子在同一直线上
难度: 中等查看答案及解析
-
一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )

A.工业上通过电解熔融的WX来制得W
B.W、X、Y、Z的原子半径顺序为:W > X > Y > Z
C.W、X、Z元素各自形成的简单离子均能破坏水的电离平衡
D.该漂白剂中各元素均满足8电子稳定结构
难度: 中等查看答案及解析
-
我国科学家开发设计一种天然气脱硫装置,利用如图装置可实现:H2S+O2=H2O2 +S↓。已知甲池中有如下的转化:
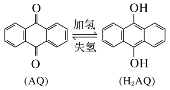
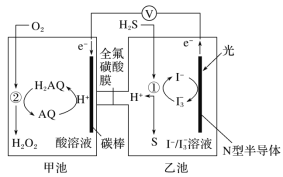
下列说法正确的是( )
A.该装置工作时,只将光能转化为电能
B.该装置工作时,溶液中的H+从甲池经过全氟磺酸膜进入乙池
C.乙池①处发生反应:H2S+I
=3I-+S↓+2H+
D.该装置每处理H2S 2.24L,甲池溶液就增重3.4g
难度: 中等查看答案及解析
-
下列实验中,实验操作、装置、现象及结论都正确的是
选项
实验操作或装置
实验现象
相关解释及结论
A.
用两支试管各取5 mL 0.1 mol·L-1酸性KMnO4溶液,分别加入2 mL 0.1 mol·L-1和0.2 mol·L-1 H2C2O4溶液
两试管溶液均褪色,且加0.2 mol·L-1H2C2O4的试管中褪色更快
其他条件不变,H2C2O4浓度越大,化学反应速率越大
B.
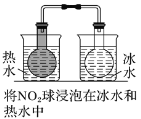
左球气体颜色加深,右球气体颜色变浅
勒夏特列原理
C.
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D.

饱和Na2CO3溶液上有透明的不溶于水的油状液体产生
乙酸乙酯难溶于水
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
恒温25 ℃下,向一定量的0.1 mol·L-1的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-lgc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )

A.BOH为弱碱且Kb的数量级为10-5
B.b点溶液中:c(B+)=c(Cl-)
C.c点溶液中水的电离程度最大
D.c~d点间溶液中:c(BOH)+c(OH-)>c(H+)
难度: 困难查看答案及解析
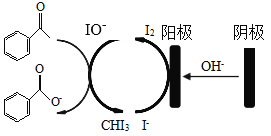

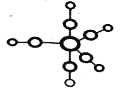
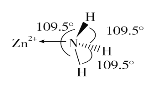

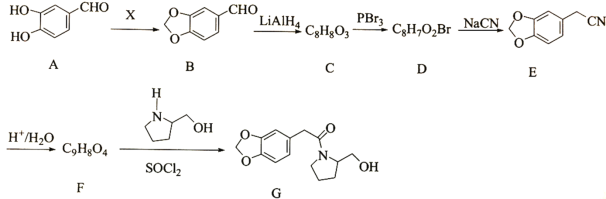
 ;
;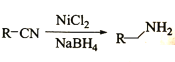
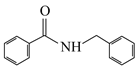 的合成线路(无机试剂任选)
的合成线路(无机试剂任选)