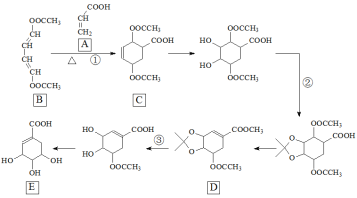
-
2020年5月长征五号B运载火箭首飞任务取得圆满成功,拉开了我国载人航天工程“第三步”任务的序幕。下列关于“长五B”的说法错误的是
A.“长五B”大量使用的碳纤维复合材料属于碳的新型同素异形体
B.发射过程应用了氧化还原反应释放的强大化学能为火箭提供动力
C.采用液氧、液氢替代四氧化二氮、偏二甲肼作为推进剂,对环境更友好
D.箭体使用的铝合金材料既可减轻飞行器本体重量,还可以保证箭体具有高强度
难度: 简单查看答案及解析
-
以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线。制备CH3OH的反应转化关系如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是
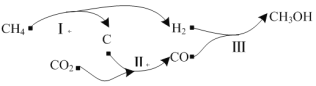
A.用1 mol CH4理论上能生产标准状况下CH3OH 22.4 L
B.等物质的量的CH3OH和CH4,CH3OH的质子数比CH4多8NA
C.44 g CO2气体和44 g CH4与CO的混合气体,所含C原子数均为NA
D.用CH4制备合成气的反应中,若生成1 mol CO,反应转移电子数为3NA
难度: 困难查看答案及解析
-
下列实验目的能实现的是
实验目的
操作步骤及现象
A
研究浓度对化学平衡的影响
2mL 0.001 mol·L-1FeCl3溶液与2mL 0.01 mol·L-1KSCN溶液混合后等分到两支试管,一支加入2mL 0.1 mol·L-1FeCl3溶液,另一支加入2mL H2O,第一支试管中溶液颜色较深
B
证明MnO2是双氧水分解的催化剂
准备两支各装有3%H2O2溶液5mL的试管,一支作对照,向另一支加入1.0g MnO2,发现加入MnO2的试管迅速产生大量气泡,证明MnO2是催化剂
C
比较AgCl和AgI溶度积的大小
向试管中加入2mL 0.1 mol·L-1AgNO3溶液,滴加0.1 mol·L-1NaCl溶液3mL,再滴加0.1 mol·L-1KI溶液,沉淀由白色变黄色
D
研究浓度对反应速率的影响
分别向盛有2 mL 0.1 mol·L-1和2mL 0.2 mol·L-1 KMnO4溶液的两支试管中加入5 mL 0.1 mol·L-1 H2C2O4,第一支试管中溶液先褪色
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
中医经典方剂组合对“COVID-19”的治疗显示出良好的临床疗效。其中有效成分之一黄芩苷结构简式如图所示,下列说法错误的是
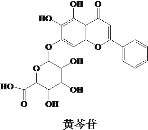
A.黄芩苷可发生取代、加成、氧化、还原反应 B.黄芩苷是芳香族化合物,其分子式为C21 H16 O11
C.黄芩苷分子中苯环上的一氯代物只有4种 D.1 mol黄芩苷最多能消耗3mol NaOH
难度: 简单查看答案及解析
-
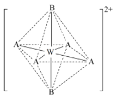
X、Y、Z、W为短周期主族元素且原子序数依次增大,X原子在元素周期表中半径最小,有机物中都含有Y元素,Y、Z、W同周期,由四种元素形成的一种化合物甲的结构如图所示。下列说法错误的是
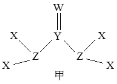
A.最高化合价:W> Z>Y> X
B.(YZ)2和YW2均为直线型分子
C.化合物甲的一种同分异构体可能既有离子键又有共价键
D.X分别与Y、Z、W形成电子总数为10的分子,沸点最高的是X2W
难度: 简单查看答案及解析
-
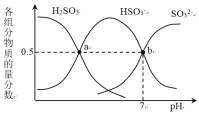
常温下,将CO2通入1L 0.01 mol·L-1 的某一元碱MOH溶液中,溶液中水电离出的OH-离子浓度[c水(OH-)]与通入的CO2的体积(V)的关系如图所示,下列叙述错误的是
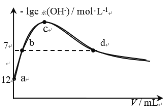
A.MOH为一元强碱
B.b点溶液中:c(H+) = 1×10-7 mol·L-1
C.c点溶液中:c(M+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(M+)=2c(CO32-)+c(HCO3-)
难度: 中等查看答案及解析
-
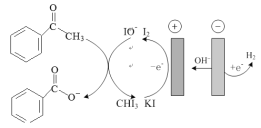
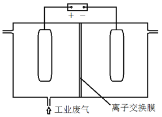
“打赢蓝天保卫战”,就意味着对污染防治提出更高要求。实验室中尝试对垃圾渗透液再利用,实现发电、环保二位一体,当该装置工作时,下列说法错误的是

A.该装置实现了将化学能转化为电能
B.盐桥中Cl-向A极移动
C.工作时,B极区溶液pH增大
D.电路中流过7.5mol电子时,共产生44.8 L N2
难度: 中等查看答案及解析