-
下列说法不正确的是( )
A.晶格能由大到小:MgO>CaO>NaF> NaCl
B.某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时生成的阳离子是X2+
C.熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、离子晶体
D.含极性键的非极性分子往往是高度对称的分子,比如CO2、BF3、CH4这样的分子
难度: 简单查看答案及解析
-
通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
A.CH4和NH4+是等电子体,键角均为60°
B.NO3-和CO32-是等电子体,均为平面正三角形结构
C.H3O+和PCl3是等电子体,均为三角锥形结构
D.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
经X射线研究证明:PCl5在固体状态时,由空间构型分别是正四面体和正八面体两种离子构成,下列关于PCl5的推断正确的是( )
A.PCl5固体是分子晶体
B.PCl5晶体具有良好的导电性
C.PCl5晶体有[PCl4]+和[PCl6]-构成,其离子数目之比为1∶1
D.PCl5晶体有[PCl3]2+和[PCl7]2-构成,其离子数目之比为1∶1
难度: 中等查看答案及解析
-
金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关
和
的说法中正确的是
A.
和
的质量数相同,互称为同位素
B.
和
的质子数相同,互称为同位素
C.
和
的质子数相同,是同一种核素
D.
和
核外电子数相同,中子数不同,不能互称为同位素
难度: 简单查看答案及解析
-
下列说法正确的是
A. 含有非极性键的分子不一定是共价化合物
B. 分子间作用力比化学键弱得多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响
C. 根据π键的成键特征判断C=C键能是C﹣C键能的2倍
D. H2O中心原子采取sp杂化
难度: 中等查看答案及解析
-
周期表中27号元素钴的方格中注明“3d74s2”,由此可以推断( )
A.它位于周期表的第四周期ⅡA族
B.它的基态核外电子排布式可简写为[Ar]4s2
C.Co2+的核外价电子排布式为3d54s2
D.Co位于周期表中第9列
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期元素。Y和Z位于同一周期,可组成中学常见的共价化合物YZ和YZ2,X和Z最外层电子数之和与W的最外层电子数相同,25℃0.01mol·L-1 X和W形成化合物的水溶液pH为2,下列说法正确的是
A. Y元素的非金属性大于W元素
B. X和Y可以形成既含极性键又含非极性键的分子
C. YZ和YZ2均可以被NaOH溶液直接吸收
D. X和W形成的化合物中各原子均为8电子稳定结构
难度: 中等查看答案及解析
-
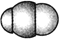
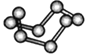
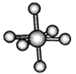
观察下列模型并结合有关信息进行判断,下列说法错误的是( )
HCN
S8
SF6
B12结构单元
结构模型
示意图
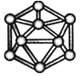
备注
/
易溶于CS2
/
熔点1873 K
A. HCN的结构式为H—C≡N,分子中“C≡N”键含有1个σ键和2个π键
B. 固态硫S8属于原子晶体,分子中S原子采用sp3杂化
C. SF6是由极性键构成的非极性分子,分子构型为八面体型
D. 单质硼属于原子晶体
难度: 中等查看答案及解析
-
根据价层电子对互斥模型,判断下列分子或者离子的空间构型不是三角锥形的是( )
A. PCl3 B. HCHO
C. H3O+ D. PH3
难度: 中等查看答案及解析
-
下列说法正确的是
A. 鉴别晶体与非晶体可用X-射线衍射实验
B. 钾焰色反应的紫色辐射波长比钠焰色反应的黄光的波长要长
C. 元素周期表s区、d区及ds区一定都是金属元素
D. 两种元素的电负性相差越大,越易形成共价化合物
难度: 中等查看答案及解析
-
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示。以下有关该物质的说法中不正确的是( )

A.每个N5+中含有35个质子和34个电子
B.该离子中有非极性键和配位键
C.该离子中含有4个π键
D.与PCl4+互为等电子体
难度: 中等查看答案及解析
-
已知短周期元素的离子xX2+、yY+、zZ3-、wW-具有相同的电子层结构,下列叙述正确的是
A.电负性:X>Y>Z>W B.原子序数:w>z>y>x
C.离子半径:Z3->W->Y+>X2+ D.元素的第一电离能:X>Y>W>Z
难度: 中等查看答案及解析
-
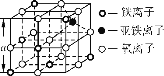
高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 晶体中与每个K+距离最近的O2-有6个
C. 晶体中,所有原子之间都以离子键相结合
D. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
难度: 中等查看答案及解析
-
有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是
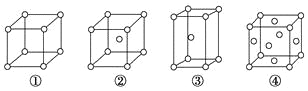
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
难度: 中等查看答案及解析
-
下列数据是对应物质的熔点,有关的判断错误的是( )
Na2O
Na
AlF3
AlCl3
Al2O3
BCl3
CO2
SiO2
920℃
97.8℃
1291℃
190℃
2073℃
-107℃
-57℃
1723℃
A. 含有金属阳离子的晶体就一定是离子晶体
B. AlCl3可能形成共价化合物分子
C. 同族元素的氧化物可形成不同类型的晶体
D. 金属晶体的熔点不一定比分子晶体的高
难度: 中等查看答案及解析
-
下列晶体分类中正确的是一组是
离子晶体
原子晶体
分子晶体
A
NaOH
Ar
SO2
B
H2SO4
石墨
S
C
CH3COONa
水晶
D
Ba(OH)2
金刚石
玻璃
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
氯仿
常因保存不慎而被氧化,产生剧毒物光气
:
,下列说法不正确的有
A.
分子为含极性键的非极性分子
B.
分子中含有3个
键、一个
键,中心C原子采用
杂化
C.
分子中所有原子的最外层电子都满足8电子稳定结构
D. 使用前可用硝酸银稀溶液检验氯仿是否变质
难度: 中等查看答案及解析
-
通常状况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是
A.NCl3分子中N—Cl键的键长比CCl4分子中C—Cl键的键长长
B.NCl3分子是非极性分子
C.分子中的所有原子均达到8电子稳定结构
D.NBr3比NCl3易挥发
难度: 中等查看答案及解析
-
铁有δ、γ、α三种同素异形体,其晶胞结构如图所示,下列判断正确的是
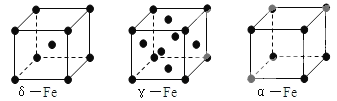
A.δ、γ、α铁晶体中存在金属阳离子和阴离子
B.γ—铁晶体晶胞中所含有的铁原子数为14
C.δ、α两种晶胞中铁原子的配位数之比为4∶3
D.若α-Fe晶胞边长为a cm,γ-Fe晶胞边长为b cm,则两种晶体的密度比为b3∶a3
难度: 中等查看答案及解析