-
O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为___________。
(2)第一电离能I1:N__________O(填“>”或“<”),第二电离能I2:O大于N的原因是___________。
(3)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为N…H—N、_________(任写两种)。
(4)已知:表格中键能和键长数目。
化学键
键长/pm
键能/(kJ·mol-1)
N—N
145
193
N=N
125
418
N≡N
110
946
N2和N4都是N元素的单质,其中N4是正四面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是_________。
高二化学填空题中等难度题查看答案及解析
-
前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占锯3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I)
I1
I2
I3
I4
I5
电离能/kJ·mol-1
800.6
2427
3660
25026
32827
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是______________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
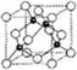
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。
①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。
高二化学推断题困难题查看答案及解析
-
硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有__________种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的电子排布式为:__________
(2)经测定发现N2O5固体由NO2+和NO3-两种离子组成,该固体中N 原子杂化类型分别为__________;与NO2+互为等电子体的微粒有_______________ (写出一种)。
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是___________,原因是_____________________
(4)第二周期中,第一电离能介于B元素和N元素间的元素有__________种。
(5)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:
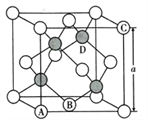
①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0 );B为(1/2,1/2,0) ;C为(1,0,1)。则D原子的坐标参数为____________________。
②己知氮化镓晶胞的边长为anm,其密度为dg/cm3。则阿伏伽德罗常数NA=__________( 用a、d表示)
高二化学综合题中等难度题查看答案及解析
-
硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有_____ 种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为_______。
(2)经测定发现,N2O5固体由NO2+ 和NO3-两种离子组成,该固体中N原子杂化类型为_______;与NO2+互为等电子体的微粒有_________(写出一种)。
(3)HF和HI电离出H+较难的是____(填化学式,下同)。铵盐大多不稳定,请预测NH4F、NH4I中,较易分解的是_____。
(4)第二周期中,第一电离能介于B元素和N元素间的元素为_______(填“元素符号”)。
(5)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体( 见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由____个硼原子构成;若该结构单元中有2 个原子为10B(其余为11B),那么该结构单元有_____种不同类型。
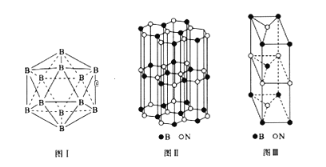
(6)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,B、N原子相互交替排列(见图II),其晶胞结构如图III所示。该晶胞有____个B和____个N。
高二化学综合题困难题查看答案及解析
-
硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题。
(1)N原子核外有___ 种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为___________。
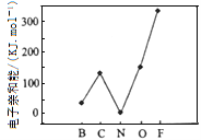
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______________________;氮元素的E1呈现异常的原因是_______________________。
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___________________。
(4)铵盐大多不稳定。NH4F、NH4I中,较易分解的是____,原因是__________________。
(5)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(6)已知:①NO2 + CO
CO2 + NO
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2
CO
CO2
NO
812kJ
1076kJ
1490kJ
632kJ
②N2(g)+O2(g)
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
高二化学综合题中等难度题查看答案及解析
-
硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有___ 种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为____________________________。
(2)经测定发现,N2O5固体由NO2+ 和NO3-两种离子组成,该固体中N原子杂化类型为_________;与NO2+互为等电子体的微粒有_______(写出一种)。
(3)HF和HI电离出H+较难的是________(填化学式,下同)。铵盐大多不稳定,请预测NH4F、NH4I中,较易分解的是________。
(4)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(5)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体( 见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由_______个硼原子构成;若该结构单元中有2 个原子为10B(其余为11B),那么该结构单元有_____种不同类型。
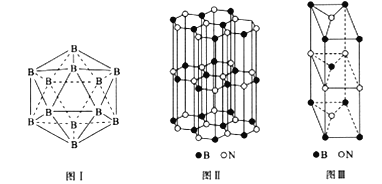
(6)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,B、N原子相互交替排列(见图II),其晶胞结构如图III所示。该晶胞有_____个B和_____个N。
高二化学综合题困难题查看答案及解析
-
氮的单质及一些化合物在工农业生产等领域有重要作用,回答下列问题
(1)N原子核外有________不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道形状为_____________________;
(2)N与同一周期中左右相邻的两种元素原子的第一电离能大小关系为______________(填元素名称),该电离能大小变化的原因为______________________________________________;
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为____________________;与NO2+互为等电子体的微粒有_______________(写出一种)。
(4)含氮的某些配体可与Co3+配位,请判断Co元素位于元素周期表中的____________区(填s、p、d、ds或f),试写出该Co元素基态原子的核外电子排布式________________________;Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数为_______________。已知配体N3-与CO2为等电子体,判断N3-的空间立体构型为_____________________。
(5)已知N的电负性大于Cl,NCl3能与水发生剧烈的水解反应,反应得到两种高中常见的化学物质,则发生的化学方程式为_______________________________________________。
(6)由H、C、N、O四种元素共同组成的四原子分子具有多种不同的结构,请写出其中两种满足稳定结构的链状异构体的电子式____________________、______________________;
高二化学综合题中等难度题查看答案及解析
-
A、B、C、D、E均为短周期元素,非金属元素A的最外层电子数与其周期数相等,B的成对电子与未成对电子所占据的原子轨道数相等。单质B在单质C中充分燃烧生成BC2。 D+与C2-具有相同的电子数。A在E中燃烧,产物溶于水会得到一种强酸。
(1)B在元素周期表中的位置是________,写出一种工业制备单质E的化学方程式:_____。
(2)B、C、D组成的一种盐中,B的质量分数为17. 91%,D的质量分数为34. 3 3%。该盐的化学式为________,其阴离子中B原子的杂化方式为__________。
(3)由这些元素组成的某些物质的组成和结构信息如下表:
物质
组成和结构
a
A、D两元素组成的离子化合物
b
由C、D两元素组成的含有非极性键的离子化合物
c
化学组成为BCE2
a的电子式为_________;b的化学式为________;c的空间构型为___________。
高二化学简答题困难题查看答案及解析
-
X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z的原子最外层电子数是其内层的3倍。回答下列问题:
(1)单质X的晶体类型为____________,其中X原子的配位数为______________。
(2)已知元素Y可与元素Z的相对原子质量只差为16,则元素Y基态原子的外围电子排布图为_____________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是___________________(写化学式),该酸根离子的立体构型为_________________。
(3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是______________________。
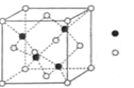
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为______________________。
(5)X与Y形成的一种化合物的立方晶胞如图所示。该化合物的化学式为____________,已知此晶体的密度为ρg·cm–3,阿伏加德罗常数为NA,则此晶胞中X与Y的最近距离是______________cm。(写出计算式,不要求计算结果。)
高二化学推断题困难题查看答案及解析
-
A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。

(1)E在同期表中的位置是________,其基态原子的简化电子排布式为________。
(2)CB
的立体构型是________。
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为________(填离子符号);D2C的熔点比CaF2熔点________(填“高”、“低”或“无法比较”)。
高二化学填空题困难题查看答案及解析