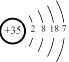-
下列物质中,只含有共价键的是
A. MgCl2 B. NaOH C. SO2 D. NH4Cl
难度: 中等查看答案及解析
-
下列属于取代反应的是( )
A. 乙烯与水反应生成乙醇 B. 甲烷与氯气反应生成一氯甲烷
C. 乙醇与氧气反应生成乙醛 D. 乙烯与高锰酸钾溶液反应生成CO2
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.碳酸钙与稀盐酸反应:CO32-+2H+ =CO2↑+H2O
B.氯化亚铁溶液与氯水反应:Fe2++ Cl2=Fe3++2Cl-
C.氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓
D.铜与稀硝酸反应:Cu+4H+ +2NO3-=Cu2++2NO2↑+2H2O
难度: 中等查看答案及解析
-
下列物质中,属于高分子化合物的是
A.苯 B.聚乙烯 C.乙酸 D.甲烷
难度: 简单查看答案及解析
-
下列物质中,属于电解质的是
A.氯化钠 B.蔗糖 C.石墨 D.稀硫酸
难度: 简单查看答案及解析
-
下列金属中,工业上常用电解法冶炼的是
A.Cu B.Ag C.Fe D.Al
难度: 简单查看答案及解析
-
当光束通过下列分散系时,能观察到丁达尔效应的是
A.盐酸 B.蔗糖溶液 C.Fe(OH)3胶体 D.NaCl溶液
难度: 中等查看答案及解析
-
下列物质中,含有碳碳双键
)的是
A.乙烯 B.乙烷 C.乙醇 D.乙酸
难度: 中等查看答案及解析
-
下列元素中,原子半径最大的是
A.Na B.Al C.K D.Cl
难度: 简单查看答案及解析
-
下列关于物质分类的叙述中,不正确的是
A.硫酸属于酸 B.液氨属于混合物
C.二氧化碳属于氧化物 D.氢氧化钙属于碱
难度: 简单查看答案及解析
-
下列反应中,属于吸热反应的是
A.Na与H2O的反应 B.Al与盐酸的反应
C.NaOH与盐酸的反应 D.Ba(OH)2·8H2O与NH4Cl的反应
难度: 中等查看答案及解析
-
下列关于物质性质的描述中,不正确的是
A.S:淡黄色固体 B.Cl2:有氧化性 C.HCl:只有酸性 D.Na:银白色固体
难度: 简单查看答案及解析
-
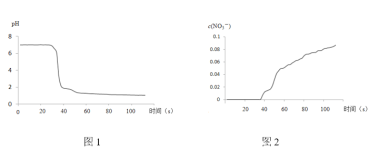
氮循环是生态系统物质循环的重要组成部分,人类活动影响了氮循环中的物质转化,如图所示。下列说法中,不正确的是

A.固氮过程中,发生了氧化还原反应
B.硝化过程需要有氧化剂参与
C.反硝化过程有助于稳定N2在大气中的含量
D.同化过程,氮元素从有机物转移至无机物
难度: 中等查看答案及解析
-
羰基硫(COS)可用于合成除草剂和杀虫剂。一定条件下,恒容密闭容器中,发生反应H2S(g)+CO2(g)
COS(g)+H2O(g),能充分说明该反应已经达到化学平衡状态的是
A. 正、逆反应速率都等于零
B. H2S、CO2、COS、H2O的浓度相等
C. H2S、 CO2、COS、H2O的浓度不再变化
D. H2S、CO2、COS、H2O在密闭容器中共存
难度: 简单查看答案及解析
-
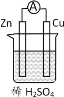
控制变量是科学研究的重要方法。相同质量的锌与足量稀硫酸在下列条件下发生反应,初始阶段反应速率最快的是( )
A
B
C
D
锌的状态
块状
块状
粉末
粉末
c(H2SO4)/(mol·L−1)
1
2
1
2
t/℃
20
40
20
40
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
高铁动车车厢禁止吸烟。高铁装有的离子式烟雾传感器具有稳定性好、灵敏度高的特点,其主体是一个放有镅(
)放射源的电离室。下列关于
的说法中,不正确的是

A.质子数为95 B.中子数为146 C.核外电子数为146 D.质量数为241
难度: 简单查看答案及解析
-
下列关于乙醇的说法中,不正确的是
A.官能团为—OH B.能与NaOH溶液反应
C.能与Na反应 D.能与CH3COOH反应
难度: 简单查看答案及解析
-
下列物质的电子式书写正确的是( )
A.H:O:H B.
C.
D.
难度: 简单查看答案及解析
-
某元素原子的结构示意图为
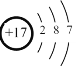 ,由此得出的结论不正确的是
,由此得出的结论不正确的是A.元素符号是Cl
B.原子半径大于S
C.在周期表中的位置是第3周期,第ⅦA族
D.在化学反应中易得电子
难度: 中等查看答案及解析
-
在实验室或生产生活中,安全措施是避免伤害和事故的保障。下列安全问题的处理方法中,不符合要求的是
A.点燃氢气前,必须检验气体的纯度
B.金属钠着火时应立即用沙土盖灭
C.大量氯气泄漏时,迅速离开现场并尽量往高处去
D.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
难度: 中等查看答案及解析
-
水饺是中华传统美食。下列制作水饺的主要过程中,包含过滤操作的是
A.和面、饧面
B.剁馅、拌馅
C.擀皮、包饺子
D.煮熟、捞饺子




A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法中,正确的是
A.0.1mol·L-1KCl溶液中含有0.1molK+ B.Fe的摩尔质量是56g·mol-1
C.1molN2中含有的原子数约为6.02×1023 D.常温常压下,1molCO的体积是22.4L
难度: 简单查看答案及解析
-
硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,不正确的是
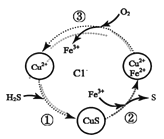
A.过程①中,生成CuS的反应为H2S+Cu2+=CuS↓+2H+
B.过程②中,Fe3+作氧化剂
C.回收S的总反应为2H2S+O2=2H2O+2S↓
D.过程③中,各元素化合价均未改变
难度: 中等查看答案及解析
-
下列“实验结论”与“实验操作及现象”不相符的一组是
选项
实验操作及现象
实验结论
A
向KI―淀粉溶液中滴加氯水,溶液变成蓝色
氧化性:Cl2>I2
B
向蔗糖中滴加浓硫酸,蔗糖变黑
浓硫酸有吸水性
C
向某盐溶液中滴加KSCN溶液,溶液变为红色
该溶液中含有Fe3+
D
向某盐溶液中加入浓NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝
该溶液中含有
A.A B.B C.C D.D
难度: 中等查看答案及解析