-
下列现象与氢键有关的是:
①NH3的熔、沸点比PH3的高 ②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小 ④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
A. ①②③④⑤⑥ B. ①②③④⑤ C. ①②③④ D. ①②③
难度: 简单查看答案及解析
-
下列分子中,既含有σ键,又含有π键的是( )
A.CH4 B.HCl C.CH2===CH2 D.F2
难度: 简单查看答案及解析
-
某元素的原子核外有三个电子层,其3p能级上的电子数是3s能级上的一半,则此元素是( )
A.S B.Al C.Si D.Cl
难度: 简单查看答案及解析
-
关于原子轨道的说法正确的是 ( )
A.凡是中心原子采取sp3杂化轨道成键的分子其空间构型都是正四面体型
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
难度: 中等查看答案及解析
-
下列叙述错误的是( )
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同( )
A.①③ B.②④ C.②⑤ D.④⑥
难度: 简单查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线型的共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.
、
、
是三种不同的核素 B.
和
互为同位素
C.
、
互为同素异形体 D.同一元素形成的不同微粒具有相同的化学性质
难度: 简单查看答案及解析
-
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A. :He B.
C. 1s2 D.
难度: 简单查看答案及解析
-
某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是( )
A.电子排布式为1s22s22p63s23p63d34s2
B.该元素为V
C.该元素为ⅡA族元素
D.该元素位于d区
难度: 简单查看答案及解析
-
某元素的电离能(电子伏特)如下:
14.5
29.6
47.4
77.5
97.9
551.9
666.8
此元素位于元素周期表的族数是( )
A.IIIA B.IVA C.VIA D.VA
难度: 简单查看答案及解析
-
元素
、
、
在周期表中的相对位置如图所示。已知
元素原子的外围电子排布式为
,则下列说法不正确的是( )
A.
元素原子的价电子排布式为
B.
元素在元素周期表的第三周期第ⅥA族
C.
元素所在周期中所含非金属元素最多
D.
元素原子的核外电子排布式为
难度: 中等查看答案及解析
-
关于第二周期的4种非金属元素B、C、N、O,下列说法中错误的是( )
A.非金属性依次增强 B.第一电离能依次增大
C.电负性依次增大 D.原子半径依次减小
难度: 简单查看答案及解析
-
二氧化硅晶体是立体的网状结构,其结构如图所示。
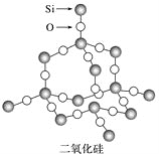
下列关于二氧化硅晶体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶角
B.在最小的环上,有3个Si原子和3个O原子
C.在最小的环上,Si和O的原子个数之比为1∶2
D.在最小的环上,有6个Si原子和6个O原子
难度: 简单查看答案及解析
-
下列不能形成配位键的组合是( )。
A.Ag+、NH3 B.H2O、H+
C.Co3+、CO D.Ag+、H+
难度: 简单查看答案及解析
-
下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H4与C2H2
难度: 中等查看答案及解析
-
2008年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺(
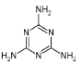 )。下列关于三聚氰胺分子的说法正确的是( )
)。下列关于三聚氰胺分子的说法正确的是( )A.所有氮原子均采用
杂化 B.一个三聚氰胺分子中共含有15个
键
C.三聚氰胺分子属于极性分子,故极易溶于水 D.三聚氰胺分子中同时含有极性键和非极性键
难度: 中等查看答案及解析
-
下列大小关系正确的是
A.熔点:NaI>NaBr B.硬度:MgO>CaO
C.晶格能:NaCl<NaBr D.熔沸点:CO2>NaCl
难度: 中等查看答案及解析
-
有四种晶体,其粒子排列方式如下所示,其中化学式不属AB型的是( )
A.
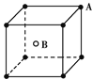 B.
B.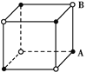
C.
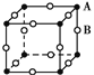 D.
D.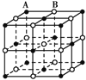
难度: 中等查看答案及解析
-
下列变化需克服相同类型作用力的是( )
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钠的溶解 D.溴和汞的气化
难度: 中等查看答案及解析
-
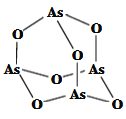
在20世纪90年代末期,科学家发现并证明碳有新的单质形态
存在。后来人们又相继得到了
、
、
、
等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
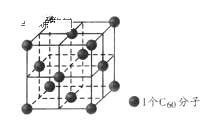
A.熔点比较:
B.
、
、管状碳和洋葱状碳之间的转化属于化学变化
C.
晶体结构如上图所示,每个
分子周围与它最近且等距离的
分子有12个
D.
、
、管状碳和洋葱状碳都不能与
发生反应
难度: 中等查看答案及解析
-
关于下列几种离子晶体,说法不正确的是( )
A.由于
晶体和
晶体中正、负离子半径比
不相等,所以两晶体中离子的配位数不相等
B.
晶体中,
配位数为8,
配位数为4,不相等,主要是由于
、
电荷数(绝对值)不相同
C.
的熔点比的
高主要是因为
的晶格能比
大
D.
晶体固态时也能导电
难度: 中等查看答案及解析
-
下表中列出了有关晶体的说明,错误的是( )
选项
A
B
C
D
晶体名称
氯化钾
氩
白磷(P4)
烧碱
构成晶体微粒名称
阴、阳离子
原子
分子
阴、阳离子
晶体中存在的作用力
离子键
共价键、范德华力
共价键、范德华力
离子键、共价键
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列对分子性质的解释中,不正确的是( )
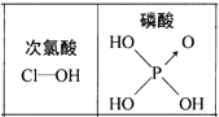
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.乳酸(
)存在对映异构体,因为其分子中含有一个手性碳原子
C.在NH3分子中存在极性共价键和配位键
D.由上图知酸性:
,因为
分子中有非羟基氧原子
难度: 中等查看答案及解析
-
晶体的晶胞结构与
晶体的相似(如下图所示),但
晶体中由于哑铃形
的存在,使晶胞沿一个方向拉长。则关于
晶体的描述不正确的是( )
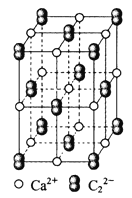
A.
晶体的熔点较高,硬度也较大
B.与
距离相同且最近的
构成的多面体是正六面体
C.与
距离相同且最近的
有4个
D.上图的结构中共含有4个
和4个
难度: 中等查看答案及解析
-
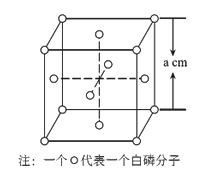
晶胞如图所示,在晶胞中,●表示
,○表示
。已知
晶体的密度为
,
的摩尔质量为
,阿伏加德罗常数为
,则在
晶体中每个
和与之等距且最近的
之间的距离为( )
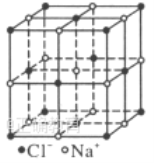
A.
cm B.
cm C.
cm D.
cm
难度: 中等查看答案及解析