-
A、B、C、D、E是前36号元素。其中A与B在周期表中位置相邻,A原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;B的基态原子有7种不同运动状态的电子;C原子在同周期原子中原子半径最大(稀有气体除外);D原子的L电子层中有两个未成对电子,且无空轨道;E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、D四种元素第一电离能从小到大顺序为_____。
(2)A的稳定氧化物中,中心原子的杂化类型为____,空间构型为_____。
(3)C与电负性最大的元素形成的化合物与B的氢化物熔沸点______更高,原因是_______。
(4)E的某种化合物的结构如图所示。
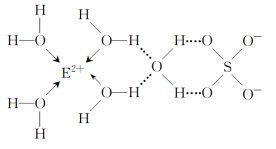
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有____。
A: 离子键 B: 共价键 C: 配位键 D: 氢键
(5)元素金(Au)处于周期表中的第六周期,与E同族。一种E合金晶体具有立方最密堆积的结构,在晶胞中E原子处于面心,金原子处于顶点位置,则该合金中E原子与金原子数量之比为____;该晶体中,原子之间的作用力是_____。
(6)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为____。
-
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题(注意:答题时A、B、C、D、E用所对应的元素符号表示):
(1)A、B、C、D四种元素电负性由大到小排列顺序为____。
(2)B的氢化物的结构式是____,其空间构型为____。
(3)E核外电子排布式是____,E的某种化合物的结构如图所示。微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有____。
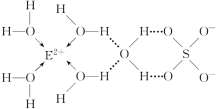
(4)A与B的气态氢化物相比,沸点更高的是____(填化学式);
(5)A的稳定氧化物中,中心原子的杂化类型为____,空间构型为____。
-
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为________________________________________。
(2)B的氢化物的结构是____________________________,其空间构型为____________________________________________________。
(3)E核外电子排布式是__________________,E的某种化合物的结构如下图所示。
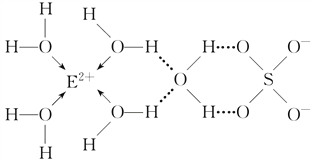
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有______________________。
(4)A与B的气态氢化物的沸点________更高,A与D的气态氢化物的沸点________更高。
(5)A的稳定氧化物中,中心原子的杂化类型为________,空间构型为________。
-
(14分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B 、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)

(1)A、B、C、D四种元素电负性由大到小排列顺序为________
(2)C形成的晶体中,其微粒堆积方式为________;
(3)D单质的熔点很高,可用作计算机的核心部件,但会被氢氧化钠溶液腐蚀,其腐蚀的离子方程式为: ________;D的氧化物在通讯方面有重要用途,90克D的氧化物中含共价键的数目为________。
(4)E核外电子排布式是________,E的某种化合物的结构如图所示,则此化合物中各种粒子间的相互作用力有________
-
己知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻且A与D同族,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C 位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号或其相应化学式表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为___________________。
(2)B的氢化物的空间构型为__________。
(3)E核外电子排布式是_______________,E的某种化合物的结构如下图所示,
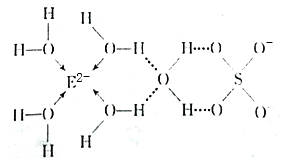
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有_______。
a.离子键 b.极性键 c.配位键 d.氢键
(4)A与B的气态氢化物的沸点_______更高,A与D的气态氢化物的沸点_______更高。
(5)A的稳定氧化物中,中心原子的杂化类型为_________,空间构型为________。
-
已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体;A、B两种元素组成的原子个数之比为1∶1的化合物N是常见的有机溶剂;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
(1)E的基态原子的价电子排布图为______。
(2)B、C、D三种元素的氢化物的沸点高低顺序为__________(用化学式表示,下同),稳定性顺序为__________。
(3)化合物M是同类物质中为数不多的气体,且分子中所有原子共平面,则M中σ键和π键个数比为____,B原子的杂化类型为____,M能和水以任意比混溶的原因是______________。
(4)E的一种氧化物Q,其晶胞结构如图1所示,则Q的化学式为____。

(5)电镀厂排放的废水中常含有剧毒的BC-,可在Q的催化下,先用NaClO将BC-氧化成BCD-,然后在酸性条件下BCD-可以继续被NaClO氧化成C2和BD2。
①与BCD-互为等电子体的分子是____(写出一种即可);可以推知BCD-的空间构型为__。
②上述反应中后一步反应的离子方程式为_____________。
(6)E内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图2所示,则E晶胞中E的配位数为____,若该晶胞的密度为a g·cm-3,阿伏加德罗常数为NA,E原子的摩尔质量为M g·mol-1,则E原子的半径为____cm。
-
(9分)现有A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X或一种+1价阳离子Y;B元素的原子有两个未成对电子;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。试回答下列问题:
(1)A、D元素的名称分别为:A ,D .
(2)X与等物质的量的HCl反应,产物溶于水得________(填“酸性”、“中性”或“碱性” )溶液,用离子方程式表示其原因 .
(3)12g B单质在空气中完全燃烧,将燃烧后的气体缓慢通入1L1 mol·L-1的NaOH溶液中,充分吸收后,最终所得溶液中各离子浓度由大到小的顺序是: __.
(4)把1molC的单质、3molA的单质置于一恒温恒容密闭容器中反应,达到平衡时,放出a kJ 的热量, 此时,容器内的压强是反应开始时的75%,写出该反应的热化学方程式 ______________________
-
(8分)前四周期元素X、Y、Z、W核电荷数依次增加,并且X、Y、Z的核电荷数之和为32;Y原子基态时被电子占据的轨道有9个,其中6个被电子占满;非金属元素Z的 M层上成对电子与未成对电子所占据的原子轨道数相等;W3+离子的3d轨道中有10个电子。
(1)W基态原子的电子排布式为_____________
(2)Y可与X形成只含一个中心原子的共价化合物a,其电子式是__________;中心原子的价层电子对数为_______;a分子的立体构型是____________
(3)Z的低价氧化物既氧化性又有还原性,请分别举例说明_____、_______(写化学方程式)。
(4)Y4分子的键角是________。我们还学过了很多与Y4空间构型相同但键角不同的分子,请列举一种分子________(写电子式)
-
A、B、C、D、E为短周期元素且它们的原子序数依次增大,A的核外电子总数与其周期数相同,其中D原子的L电子层中,成对电子与未成对电子占据的轨道数相同,并且无空轨道;B原子的L电子层中未成对电子数与D相同,但还有空轨道;D与E同族,请回答下列问题:
(1)A与其他元素形成的二元共价化合物中,一种化合物分子呈三角锥形,该分子的化学式为______,其中心原子的杂化方式为______,A分别与B、C、D形成的共价化合物中既含有极性共价键,又含有非极性键的化合物是________________________。(填化学式,任意写出三种)。
(2)这些元素形成的含氧酸根离子中,其中心原子的价层电子对数为3的酸根离子是______________________(填化学式,下同);酸根离子呈三角锥形结构的是____________。
(3)BA4分子的立体构型为__________;根据电子云重叠方式的不同,该分子里共价键的类型为_________。
(4)B的一种氢化物相对分子质量是26,其分子中σ键和π键的键数之比为_________。
(5)B与D形成BD2分子,与该分子互为等电子体的有____________________。(分子跟阴离子各写一个)
-
(1)铁在元素周期表中的位置为_____,基态铁原子有个未成对电子_____,三价铁离子的电子排布式为_____。
(2)基态Si原子中,电子占据的最高能层符号_____,该能层具有的原子轨道数为_____;铝元素的原子核外共有_____种不同运动状态的电子、_____种不同能级的电子。
(3)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_____形象化描述。在基态14C原子中,核外存在_____对自旋相反的电子。
(4)中国古代四大发明之一——黑火药,它的爆炸反应为:2KNO3+3C+S K2S+N2↑+3CO2↑,除S外,上述元素的电负性从大到小依次为_____,第一电离能从大到小依次为_____。
K2S+N2↑+3CO2↑,除S外,上述元素的电负性从大到小依次为_____,第一电离能从大到小依次为_____。
(5)有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥CH4,⑦H2,⑧H2O2,⑨HCN(H—C≡N),⑩Ar,既有σ键又有π键的是______;含有由两个原子的s轨道重叠形成的σ键的是______;不存在化学键的是______。
(6)在BF3分子中,F—B—F的键角是______,硼原子的杂化轨道类型为______,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为______。





