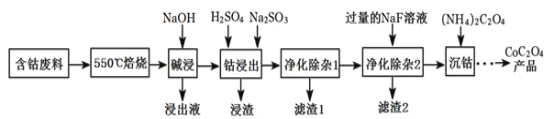
-
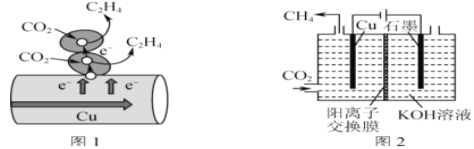
2020 年春节前后,新冠病毒肆虐全球,防控疫情已成为国际首要大事。按照以往对冠状病毒的经验,乙醚、75%乙醇、含氯的消毒剂、过氧乙酸等均可有效灭活病毒,下列有关说法错误的是
A.因乙醇易燃,不可使用酒精溶液大面积对室内空气进行消毒
B.次氯酸钠具有一定的腐蚀性和刺激性,使用时需带手套,并稀释使用
C.过氧乙酸(CH3COOOH)用于杀灭病毒是因为其含有羧基
D.不能将“84 消毒液”和酒精混合进行环境消毒
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.25℃时,pH=2的H2SO4溶液中,含有H+的数目为2×10-2NA
B.一定条件下,1molN2与3molH2混合充分反应,转移电子数目为6NA
C.常温下,1.0L0.1mol·L-1FeCl3溶液中,Fe3+的数目为0.1NA
D.用石墨电极电解足量CuSO4溶液,当阴极析出6.4gCu时,转移电子数目为0.2NA
难度: 中等查看答案及解析
-
25℃时,重水(D2O)的离子积为 1.6×10ˉ15,也可用与 pH 一样的定义来规定其酸碱度:pD=-lgc(D+),下列叙述正确的是(均为 25℃条件下)
A.重水和水两种液体,D2O 的电离度大于 H2O
B.在 100mL0.25mol·Lˉ1DCl 重水溶液中,加入 50mL0.2mol·Lˉ1NaOD 重水溶液,反应后溶液的 pD=1
C.0.01 mol·Lˉ1NaOD 重水溶液,其 pD=12
D.NH4Cl 溶于 D2O 中生成的一水合氨和水合氢离子的化学式为 NH3·D2O 和 HD2O+
难度: 困难查看答案及解析
-
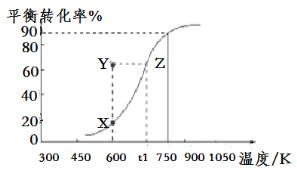
常温下,用 0.1 mol·L-1 KOH 溶液滴定 10 mL 0.1 mol·L-1 HA(Ka =1.0×10-5)溶液的滴定曲线如图所示。下列说法正确的是( )
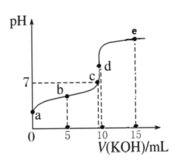
A.a 点溶液的 pH 约为 5
B.水的电离程度:c 点>d 点
C.b 点溶液中粒子浓度大小: c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
D.e 点溶液中:c(K+)=2c(A-)+2c(HA)
难度: 中等查看答案及解析
-
常温下,Ksp(ZnS)=l.6×10-24,Ksp(FeS)=6.4×10-18,其中FeS为黑色晶体,ZnS是一种白色颜料的组成成分。下列说法正确的是
A.向物质的量浓度相等的FeSO4和ZnSO4混合液中滴加Na2S溶液,先产生黑色沉淀
B.常温下,反应FeS(s)+Zn2+(aq)⇌ZnS(s)+Fe2+(aq)的平衡常数K=4.0×l06
C.在ZnS的饱和溶液中,加入FeSO4溶液,一定不会产生FeS沉淀
D.向FeS悬浊液中通入少许HC1,c(Fe2+)与Ksp(FeS)均增大
难度: 中等查看答案及解析
-
下列实验装置符合实验目的是( )
目的
粗铜的精炼
验证NaCl溶液(含酚酞)的产物
在铁制品上镀铜
构成原电池
装置
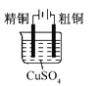
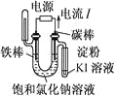
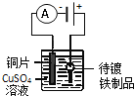
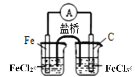
选项
A
B
C
D
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
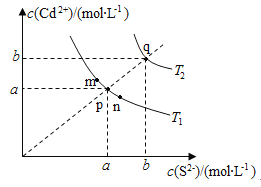
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
难度: 中等查看答案及解析