-
(1)根据氯化铁溶液回答下列问题:
①向FeCl3溶液中加入少量NaHCO3。产生的现象为___。用离子方程式表示其原因___。
②不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是___。
③在配制FeCl3溶液时,为防止溶液变浑浊,应加入___。
(2)利用反应Cu+H2O2+H2SO4=CuSO4+2H2O设计一个原电池,回答下列问题:
①负极材料为___;正极反应式为___。
②反应过程中SO 向____极移动。
向____极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了___克。
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1mol•L-1的四种溶液:pH由小到大排列的顺序是__(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___(填字母)
A.c(H+) B. C.c(H+)•c(OH-) D.
C.c(H+)•c(OH-) D. E.
E.
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____。
④25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=____(填准确数值)。
⑤标准状况下,将1.12LCO2通入100mL1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+____。
-
Na2CO3和NaHCO3是中学化学中常见的物质,在生产生活中有重要的用途
(1)常温下,0.1mol/L碳酸钠溶液pH约为12。原因是_____(用离子方程式表示)。
(2)若在FeCl3溶液中加入碳酸氢钠浓溶液,观察到红褐色沉淀和无色气体,用离子方程式解释产生该现象的原因________。
(3)工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,再经过处理最终得到Pb。
①PbCO3的溶解度______PbSO4(填“大于”或“小于”)。
②用离子方程式解释Na2CO3的作用________。
③用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大。原因是________。
(4)25℃时,在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示:
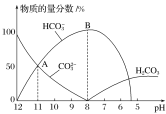
①请写出OAB段的离子方程式________。
②当pH=7时,溶液中主要含有哪些离子________。(除H+和OH-外)
-
结合所学知识回答下列问题:
(1)配制FeCl3水溶液时,常加入少量_____溶液,结合离子方程式解释原因:______。
(2)工业冶炼镁的化学方程式:_____。由氯化镁溶液制备无水氯化镁的操作是_____。
(3)锅炉水垢中的CaSO4可先用Na2CO3溶液浸泡一段时间,放出浸泡液后,再用盐酸处理,用离子方程式表示过程中发生的化学反应:_______、_____。
-
在生产生活和科学研究中,人们常常根据需要促进或抑制盐的水解.试回答下列问题:
(1)FeCl3溶液呈______ (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):______;实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,以______ (填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度.
(2)用离子方程式表示硫酸铝溶液和碳酸氢钠溶液混合时发生的主要反应______.
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是______.
A.甲同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的.
B.乙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的.
C.丙同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的.
D.丁同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的.
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是______.
-
(1)FeCl3水溶液呈酸性,原因是(用离子方程式表示)________,实验室配制FeCl3溶液的方法是加入少量的_____。
(2)泡沫灭火剂中装有Al2(SO4)3溶液、NaHCO3溶液及起泡剂。写出使用时发生反应的离子方程式:_______。
-
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
常温时,FeCl3的水溶液呈___(填“酸”“中”或“碱”)性,原因是___(用离子方程式表示);实验室配制0.01mol·L-1FeCl3的溶液时,为了抑制FeCl3的水解使溶液中不产生沉淀可加入少量的盐酸至溶液pH不大于___;若把配制的FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是___。(常温下Fe(OH)3的溶度积Ksp=1.0×10-38)
-
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)NH3的电子式______。
(2)氯化铵水溶液显酸性,其原因为______(用离子方程式表示),0.1mol/L的氨水中加入少量的NH4Cl固体,溶液的pH______(填“升高”或“降低”);若加入少量的明矾固体后,请尝试从平衡移动的角度解释溶液中NH4+浓度的变化原因______。
(3)硝酸铵加热分解可得到N2O(g)和H2O(g),250℃时,硝酸铵在密闭容器中分解达到平衡,该温度下反应的平衡常数表达式为______;若有1mol硝酸铵完全分解,转移的电子数为______mol。
(4)3H2(g)+N2(g)⇌2NH3(g)△H=-92kJ/mol,若反应放出9.2kJ 热量,则参加反应的氢气分子数目为______。
-
根据所学知识回答下列问题:
(1)用离子方程式表示盐碱地(含较多Na2CO3)呈碱性的原因:____________;相同浓度的Na2CO3溶液与NaHCO3溶液等体积混合后,溶液中c(HCO3-) ____c(CO32-)(用“>、<、=”表示)。
(2)常温时,AlCl3溶液呈____性(填“酸”、“碱”或“中”),将AlCl3溶液蒸干,灼烧,得到的固体产物是________。AlCl3溶液和NaHCO3溶液混合时发生反应的离子方程式为____________________。
-
下列离子方程式正确的是
A.NaHCO3溶液中加入少量的石灰水 HCO3-+ Ca2+ + OH-=CaCO3↓+H2O
B.向氯化铁溶液中通入硫化氢气体 3Fe3+ + H2S = 2Fe2+ + FeS↓+2H+
C.氯化铝溶液中加入过量氨水 Al3+ + 4 OH- = AlO2-+ 2H2O
D.氨水中通入过量SO2 NH3·H2O + SO2 = HSO3- + NH4+
-
下面提到的问题中,与盐的水解有关的是 ( )
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
④在NH4Cl溶液中加入金属镁会产生氢气
A.①③④ B.②③ C.全部 D.①②④
向____极移动。
C.c(H+)•c(OH-) D.
E.
