-
Na2CO3和NaHCO3是中学化学中常见的物质,在生产生活中有重要的用途
(1)常温下,0.1mol/L碳酸钠溶液pH约为12。原因是_____(用离子方程式表示)。
(2)若在FeCl3溶液中加入碳酸氢钠浓溶液,观察到红褐色沉淀和无色气体,用离子方程式解释产生该现象的原因________。
(3)工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,再经过处理最终得到Pb。
①PbCO3的溶解度______PbSO4(填“大于”或“小于”)。
②用离子方程式解释Na2CO3的作用________。
③用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大。原因是________。
(4)25℃时,在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示:
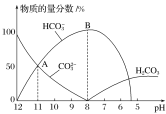
①请写出OAB段的离子方程式________。
②当pH=7时,溶液中主要含有哪些离子________。(除H+和OH-外)
-
(6分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O。
依照该规律,请判断下列反应不能成立的是 (填编号)。
A.CO2+H2O+2NaClO===Na2CO3+2HClO
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是 (填编号),其pH值约为 (填数值)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
-
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3 = 2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O +2NaClO = Na2CO3+2HClO
B.CO2+H2O +NaClO = NaHCO3+HClO
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN = CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是_________(填编号),其pH值为_______(填数值);pH最大的是________(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
请根据上述反应,总结出复分解反应发生的另一规律:_____________________。
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是____________________,反应的离子方程式为____________________________。
-
钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1 mol/L的下列五种钠盐溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述几种钠盐的阴离子,结合氢离子能力最强的是______(填离子符号),根据表中数据,将浓度均为0.01mol/L的下列四种溶液分别稀释100倍,pH变化最大的是______.(填字母)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)已知几种离子开始沉淀时溶液的pH如下表所示:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含有相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,________(填离子符号)先沉淀;Ksp[Fe(OH)2]______(填“>”“=”或“<”)Ksp[Mg(OH)2];要使0.2 mol/L的硫酸铜溶液中铜离子沉淀较为完全(使铜离子的浓度降至原来的千分之一),则应向溶液中加入氢氧化钠溶液使溶液pH=_______。{Cu(OH)2的Ksp=2×10-20。}
-
(10分)钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A. HCN B. HClO C. CH3COOH D. H2CO3
(2)实验室中常用NaOH来进行洗气和提纯。
①当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________________________。
②几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,_______(填离子符号)先沉淀, _________
_________ (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
-
钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合氢离子能力最强的是 ,根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是 (填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:
① ② (填“>”“=”“<”下同)。溶液中阴离子的物质的量浓度之和:① ②。
(3)碳酸氢钠是一种 (填“强”或“弱”)电解质;写出HCO3-水解的离子方程式: ,常温下,0.1mol/L碳酸氢钠溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为: 。
(4)实验室中常用氢氧化钠来进行洗气和提纯。
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为: 。
② 几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时, (填离子符号)先沉淀,Ksp[Fe(OH)3]
Ksp[Mg(OH)2] (填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
( Ksp[Cu(OH)2]=2×10-20mol2/L2)
-
盐酸、醋酸和氨水是中学化学中常见的三种物质,某校实验小组利用浓盐酸、冰醋酸和浓氨水分别配制了浓度均为0.1 mol·L-1的三种溶液各100 mL并进行相关实验,据此回答下列问题:
(1)常温下上述三种溶液的PH由大到小的顺序是____________________。
(2)25℃时,利用pH试纸测得0.1 mol·L-1醋酸溶液的pH约为5,则可以估算出醋酸的电离常数约为__________________;向10 mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中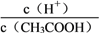 的值将_________(填“增大”“减小”或“无法确定”)。
的值将_________(填“增大”“减小”或“无法确定”)。
(3)将浓度均为0.1 mol·L-1的盐酸和氨水等体积混合,则:①所得混合溶液显_______性(填“酸性”“碱性”或“中性”),原因是__________________(用离子方程式表示)。
②所得混合溶液中所有离子的物质的量浓度由大到小的顺序为______。
-
常温下,有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的量浓度均为0.1mol·L−1,下列说法错误的是
A. Na2CO3溶液加水稀释后,溶液中c(HCO3−)/c(CO32−)的值增大
B. 将③、④等体积混合所得溶液中:2c(OH−)−2c(H+)=3c(H2CO3)+2c(HCO3−)−c(CO32−)
C. 向溶液①、②中分别滴加25mL 0.1mol·L−1盐酸后,溶液中c(NH4+):①<②
D. 将溶液①、②等体积混合所得溶液呈碱性且:c(NH4+)>c(NH3·H2O)
-
已知常温下浓度均为0.1mol/L的下列三种溶液的PH:
| 溶质 | NaHCO3 | Na2CO3 | NaCN |
| PH | 9.7 | 11.6 | 11.1 |
下列说法中正确的是
A.溶液中阳离子的物质的量浓度之和:Na 2CO3 >NaCN>NaHCO3
B.相同条件下的酸性:H 2CO3 <HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na 2CO3 溶液的温度, 减小
减小
-
常温下,有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的量浓度均为0.1mol·L−1,下列说法错误的是( )
A.四种溶液的pH的大小顺序:①>③>④>②
B.将溶液①、②等体积混合所得溶液呈碱性且:c(NH4+) >c(NH3·H2O)
C.向溶液①、②中分别滴加25mL 0.1mol·L−1盐酸后,溶液中c(NH4+):①<②
D.将溶液③、④等体积混合所得溶液中:2c(OH−)-2c(H+)=3c(H2CO3)+2c(HCO3-)-c(CO32−)

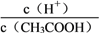 的值将_________(填“增大”“减小”或“无法确定”)。
的值将_________(填“增大”“减小”或“无法确定”)。