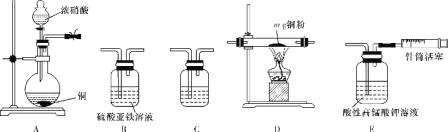
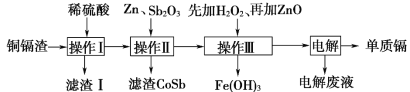
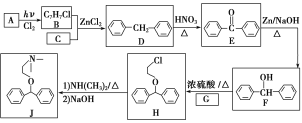
-
“中国名片”中航天、军事、天文等领域的发展受到世界瞩目,它们与化学有着密切联系。下列说法错误的是( )
A.“中国天眼”的“眼眶”是钢铁结成的圈梁,其属于黑色金属材料
B.“天宫二号”空间实验室的硅电池板将光能直接转换为电能
C.“歼-20”飞机上大量使用的碳纤维是一种新型有机高分子材料
D.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷是新型无机非金属材料
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.用CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
C.Na2O2与H2O反应生成1.12LO2(标准状况),反应转移的电子数为0.2NA
D.标准状况下,80gSO3中含3NA个氧原子,体积约为22.4L
难度: 中等查看答案及解析
-
下列各实验的叙述正确的是( )
选项
实验内容
实验目的或结论
A
某样品进行焰色反应时产生黄色火焰
该样品是钠盐
B
以酚酞作指示剂,用一定浓度的NaOH溶液滴定一定体积、一定浓度的草酸溶液
[已知K1(H2C2O4)=5.4×10-2、K2(H2C2O4)=6.4×10-5]
证明草酸是二元酸
C
将溴水、苯、FeBr3混合于烧瓶中
制备溴苯
D
常温下,用精密pH试纸分别测定浓度均为0.1mol·L-1的NaClO溶液和CH3COONa溶液的pH
比较HCl和CH3COOH的酸性强弱
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
短周期主族元素R、X、Y、Z的原子序数依次增大,化合物M、N均由这四种元素组成,且M的相对分子质量比N小16。分别向M和N中加入烧碱溶液并加热,二者均产生可使湿润的红色石蕊试纸变蓝的气体。将M溶液和N溶液混合后产生的气体通入品红溶液中,溶液变无色,加热该无色溶液,无色溶液又恢复红色。下列说法错误的是( )
A.简单气态氢化物的稳定性:Y>X
B.简单离子的半径:Z>Y
C.X和Z的简单气态氢化物能反应生成两种盐
D.X和Z的氧化物对应的水化物都是强酸
难度: 中等查看答案及解析
-
我国科研人员使用催化剂CoGa3实现了H2还原肉桂醛生成肉桂醇,反应机理的示意图如图:
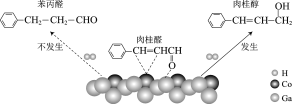
下列说法不正确的是( )
A.苯丙醛分子中有6种不同化学环境的氢原子
B.肉桂醛分子中不存在顺反异构现象
C.还原反应过程发生了极性键和非极性键的断裂
D.该催化剂实现了选择性还原肉桂醛中的醛基
难度: 中等查看答案及解析
-
世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。
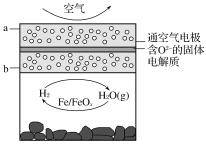
下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
难度: 困难查看答案及解析
-
已知:25℃时某些弱酸的电离平衡常数(如下表)。下面图象表示常温下稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是( )

A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO
C.图象中a、c两点处的溶液中
相等(HR代表CH3COOH或HClO)
D.图象中a点酸的浓度大于b点酸的浓度
难度: 困难查看答案及解析