-
1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为 ___。
(2)已知反应2N2O(g)=2N2(g)+O2(g)的ΔH=–163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为______kJ。
在一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:

①在0~20min时段,反应速率v(N2O)为 ___mol·L-1·min-1。
②若N2O起始浓度c0为0.150mol/L ,则反应至30min时N2O的转化率α=___。
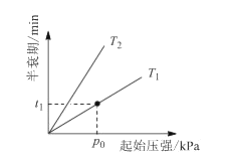
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1 ___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p= ___(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) = 2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时NO分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.温度升高,k值增大 B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关
-
1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡 剂和密封剂。
(l) N2是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为________。
(2)N2O在金粉表面发生热分解反应:2N2O(g) =2N2(g)+O2(g) △H。
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) △H1=-1010KJ/mol
4NH3(g)+3O2(g) =2N2(g)+6H2O(l) △H2=-1531KJ/mol
△H=__________。
(3)N2O和CO是环境污染性气体,研究表明,CO与N2O在Fe+作用下发生反应:N2O(g)+CO(g) CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O
CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O FeO+N2;反应②______________
FeO+N2;反应②______________
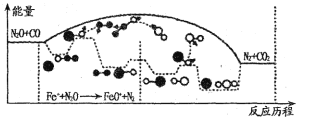
由图可知两步反应均为____(填“放热”或“吸热”)反应,由______(填“反应①或反应②”)决定反应达到平衡所用时间。
(4)在固定体积的密闭容器中,发生反应:N2O(g)+CO(g) CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
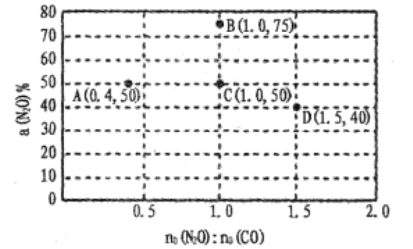
①如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是:____ ;
②图中C、D两点对应的实验温度分别为TC和TD,,通过计算判断TC____TD(填“>”“=”或“<”)。
(5)在某温度下,向1L密闭容器中充入CO与N2O,发生反应:N2O(g)+CO(g) CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 物质的量分数 | 50.0% | 40.25% | 32.0% | 26.2% | 24.0% | 24.0% |
则该温度下反应的平衡常数K=____。
-
1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡剂和密封剂。
(1)N2O是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为_________。
(2)N2O在金粉表面发生热分解反应:2N2O(g) =2N2(g)+O2(g) △H。
已知:2NH3(g) + 3N2O(g) = 4N2(g) + 3 H2O(l) △H1
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(l) △H2
△H= _________(用含△H1、△H2的代数式表示)。
(3)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO)(g)⇌CO2(g)十N2(g),“Fe+”常用作该反应的催化剂。 其总反应分两步进行:
第一步为Fe+ +N2O⇌FeO+ +N2;第二步为________(写化学方程式)。
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_______ (填“大于”“小于”或“等于”)第一步反应活化能。
(4)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应2N2O(g)⇌2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:
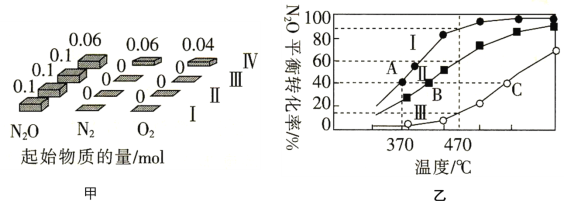
①该反应的△H________(填“>”或“<”)0。
②容器Ⅱ的体积为5L,在470℃下进行反应,30s后达到平衡,0~30s内容器Ⅱ中O2的反应速率为_________mol.L-1.min-1 ;容器Ⅳ的体积为1L,容器Ⅳ中的物质也在470℃下进行反应,起始反应速率: 正(N2O)_______
正(N2O)_______ 逆(N2O)。(填“>”“<”或“=”)
逆(N2O)。(填“>”“<”或“=”)
③图中A、B、C三点处容器内密度最大的点是_________(填“A”“B”或“C”)。
④已知容器Ⅰ的体积为10L,370℃时,该反应的平衡常数k=__________。
-
一氧化二氮(Nitrous oxide),无色有甜味气体,又称笑气,“笑气”的名称是由于吸入它会感到欣快,并能致人发笑。1799年,英国化学家汉弗莱·戴维发现了该气体。一氧化二氮早期被用于牙科手术的麻醉,现用在外科手术和牙科起麻醉和镇痛作用。
(1)N2O在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g) △H。
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) △H1
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H2
△H=________(用含△H1、△H2的代数式表示)。
(2)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO(g)  CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:第一步为Fe++N2O
CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:第一步为Fe++N2O FeO++N2;第二步为____________________(写化学方程式)。第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_____(填“大于”“小于”或“等于”)第一步反应活化能。
FeO++N2;第二步为____________________(写化学方程式)。第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_____(填“大于”“小于”或“等于”)第一步反应活化能。
(3)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应:2N2O(g)  2N2(g)+O2(g)△H,容器I、II、III中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g)△H,容器I、II、III中N2O的平衡转化率如图乙所示:
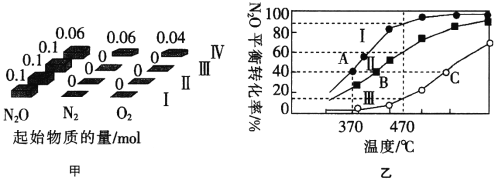
①该反应的△H______(填“>”或“<”)0。
②容器II的体积为0.5L,在470℃下进行反应,30s后达到平衡,0~30s内容器II中O2的反应速率为_______mol·L-1·s-1。
③已知容器I的体积为1L,370℃时,该反应的平衡常数k=________(保留两位有效数字)。
④图中A、B、C三点处容器内密度最大的点是________(填“A”“B”或“C”)。
-
麻醉剂是外科手术的必需品,我国古代著名医学家华佗发明了“麻沸散”,作为外科手术时的麻醉剂;近代有英国化学家戴维发明的N2O(结构式为:NNO);而今二乙醚(C2H5OC2H5)和氯仿仍是全身麻醉最常用的麻醉剂,有关麻醉剂的叙述正确的是( )
A.若N2O结构与CO2相似,则N2O为直线形极性分子
B.乙醚与乙醇互为同分异构体
C.氯仿是一种常见溶剂,易溶于水
D.氯仿为甲烷的二氯取代物,在碱溶液中可发生水解
-
氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ・mol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJ・mol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJ・mol-1
则反应2N2O(g)=2N2(g)+O2(g) △H=_______ kJ・mol-1
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如下图
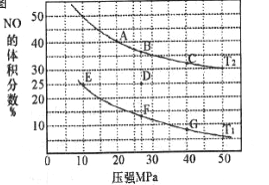
①已知T2>T1,则反应2NO(g)+2CO(g) 2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有____(填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=____,该温度下用分压表示的平衡常数Kp= ___MPa-1(分压=总压×物质的量分数)。
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中____点。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。
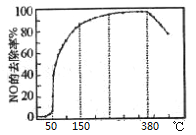
①在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是____。
②当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。
-
氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ・mol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJ・mol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJ・mol-1
则反应2N2O(g)=2N2(g)+O2(g) △H=_______ kJ・mol-1
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如下图
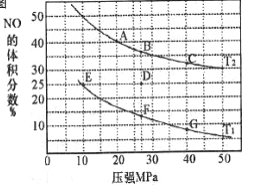
①已知T2>T1,则反应2NO(g)+2CO(g) N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有____(填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=____,该温度下用分压表示的平衡常数Kp= ___MPa-1(分压=总压×物质的量分数)。
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中____点。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。
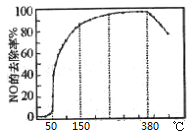
①在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是____。
②当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。
-
氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛。
(1)N2O是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为___________。已知N2O与CO2分子具有相似的结构,试画出N2O的结构式_______。
(2)N2O4可作火箭高能燃料N2H4的氧化剂。
已知:2NO2(g) N2O4(g) △H =-akJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-bkJ·mol-1;
N2O4(g) △H =-akJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-bkJ·mol-1;
N2(g)+2O2(g)=2NO2(g) △H =+ckJ·mol-1;(a、b、c均大于0)。
写出气态腁在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式___________。
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如p(NO2)=p总×x(NO2))。写出反应2NO2(g) N2O4(g) △H =-akJ·mol-1平衡常数Kp表达式________(用p总、各气体物质的量分数x表示)。
N2O4(g) △H =-akJ·mol-1平衡常数Kp表达式________(用p总、各气体物质的量分数x表示)。
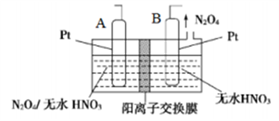
(4)新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示。则电极B接直流电源的____极,电解池中生成N2O5的电极反应式为_____________。
(5)可用氨水吸收NO2、O2生成硝酸铵,写出该反应的离子方程式_____________。
已知25℃时NH3·H2O的电离常数Kb=2×10-5,向500ml0.1mol·L-1硝酸铵溶液中通入标准状况下至少____ml氨气,使溶液呈中性(溶液的体积变化忽略不计)。
-
麻醉剂的发现和使用,是人类历史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛.
(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一.有关理论认为N2O与CO2具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为________,其空间构型是________型,由此可见它是________分子(填“极性”或“非极性”)
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒物光气(COCl2)∶2CHCl3+O2→2HCl+2COCl2,为防止中毒事故,使用前可用于检验氯仿是否变质的试剂是________.
A.酚酞试液 B.淀粉碘化钾溶液 C.NaOH溶液 D.硝酸银稀溶液
(3)作为麻醉剂,氙气在医学上备受重视.氙能溶于细胞质的油脂里,引起细胞的麻醉和膨胀,从而使神经末梢作用暂时停止.人们曾试用体积分数为80%氙气和20%氧气组成的混合气体,作为无副作用的麻醉剂.稀有气体氙的化学性质不活泼,但它在一定条件下可与其它物质反应生成化合物.现取1mol氙气和3.5mol氟气于密闭容器中,在一定条件下使反应完毕,剩余有1.5mol氟气,同时有白色固体生成,此白色固体的化学式为________.
-
 ,俗称笑气,是一种无色有甜味气体,在室温下稳定,有轻微麻醉作用,并能致人发笑。下列叙述中正确的是( )
,俗称笑气,是一种无色有甜味气体,在室温下稳定,有轻微麻醉作用,并能致人发笑。下列叙述中正确的是( )
A.笑气的摩尔质量为44 g
B. 个笑气分子的质量为44 g
个笑气分子的质量为44 g
C.1 mol笑气的质量为44 
D. g笑气含有
g笑气含有 个
个 分子
分子










