-
1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡 剂和密封剂。
(l) N2是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为________。
(2)N2O在金粉表面发生热分解反应:2N2O(g) =2N2(g)+O2(g) △H。
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) △H1=-1010KJ/mol
4NH3(g)+3O2(g) =2N2(g)+6H2O(l) △H2=-1531KJ/mol
△H=__________。
(3)N2O和CO是环境污染性气体,研究表明,CO与N2O在Fe+作用下发生反应:N2O(g)+CO(g) CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O
CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O FeO+N2;反应②______________
FeO+N2;反应②______________
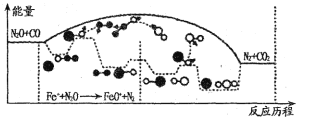
由图可知两步反应均为____(填“放热”或“吸热”)反应,由______(填“反应①或反应②”)决定反应达到平衡所用时间。
(4)在固定体积的密闭容器中,发生反应:N2O(g)+CO(g) CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
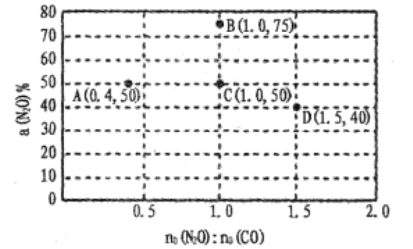
①如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是:____ ;
②图中C、D两点对应的实验温度分别为TC和TD,,通过计算判断TC____TD(填“>”“=”或“<”)。
(5)在某温度下,向1L密闭容器中充入CO与N2O,发生反应:N2O(g)+CO(g) CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 物质的量分数 | 50.0% | 40.25% | 32.0% | 26.2% | 24.0% | 24.0% |
则该温度下反应的平衡常数K=____。
-
1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡剂和密封剂。
(1)N2O是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为_________。
(2)N2O在金粉表面发生热分解反应:2N2O(g) =2N2(g)+O2(g) △H。
已知:2NH3(g) + 3N2O(g) = 4N2(g) + 3 H2O(l) △H1
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(l) △H2
△H= _________(用含△H1、△H2的代数式表示)。
(3)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO)(g)⇌CO2(g)十N2(g),“Fe+”常用作该反应的催化剂。 其总反应分两步进行:
第一步为Fe+ +N2O⇌FeO+ +N2;第二步为________(写化学方程式)。
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_______ (填“大于”“小于”或“等于”)第一步反应活化能。
(4)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应2N2O(g)⇌2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:
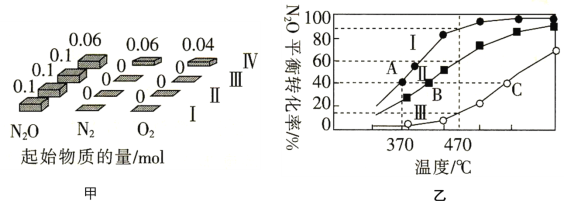
①该反应的△H________(填“>”或“<”)0。
②容器Ⅱ的体积为5L,在470℃下进行反应,30s后达到平衡,0~30s内容器Ⅱ中O2的反应速率为_________mol.L-1.min-1 ;容器Ⅳ的体积为1L,容器Ⅳ中的物质也在470℃下进行反应,起始反应速率: 正(N2O)_______
正(N2O)_______ 逆(N2O)。(填“>”“<”或“=”)
逆(N2O)。(填“>”“<”或“=”)
③图中A、B、C三点处容器内密度最大的点是_________(填“A”“B”或“C”)。
④已知容器Ⅰ的体积为10L,370℃时,该反应的平衡常数k=__________。
-
1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为 ___。
(2)已知反应2N2O(g)=2N2(g)+O2(g)的ΔH=–163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为______kJ。
在一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:

①在0~20min时段,反应速率v(N2O)为 ___mol·L-1·min-1。
②若N2O起始浓度c0为0.150mol/L ,则反应至30min时N2O的转化率α=___。
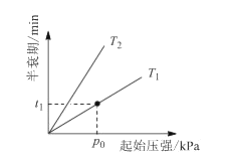
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1 ___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p= ___(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) = 2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时NO分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.温度升高,k值增大 B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关
-
在食品行业中,N2O可用作发泡剂和密封剂。
(1)N2O是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为___。
(2)N2O和NO是环境污染性气体。这两种气体会发生反应:N2O(g)+CO(g)=CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:
第一步为Fe++N2O=FeO++N2;第二步为___(写方程式),第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应的活化能___(填“大于”“小于”或“等于”)第一步反应活化能。
(3)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应2N2O(g)=2N2(g)+O2(g) △H,容器I、II、III中N2O的平衡转化率如图乙所示:

①该反应的△H___(填“>”或“<”)0。
②容器Ⅳ与容器III的体积均为1L,容器Ⅳ中的物质在470℃下进行反应,起始反应速率:v正(N2O)___v逆(N2O)(填“>”“<”或“=”)。
③已知容器I的体积为10L370℃时,该反应的平衡常数K=___。
-
一氧化二氮(Nitrous oxide),无色有甜味气体,又称笑气,“笑气”的名称是由于吸入它会感到欣快,并能致人发笑。1799年,英国化学家汉弗莱·戴维发现了该气体。一氧化二氮早期被用于牙科手术的麻醉,现用在外科手术和牙科起麻醉和镇痛作用。
(1)N2O在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g) △H。
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) △H1
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H2
△H=________(用含△H1、△H2的代数式表示)。
(2)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO(g)  CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:第一步为Fe++N2O
CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:第一步为Fe++N2O FeO++N2;第二步为____________________(写化学方程式)。第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_____(填“大于”“小于”或“等于”)第一步反应活化能。
FeO++N2;第二步为____________________(写化学方程式)。第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_____(填“大于”“小于”或“等于”)第一步反应活化能。
(3)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应:2N2O(g)  2N2(g)+O2(g)△H,容器I、II、III中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g)△H,容器I、II、III中N2O的平衡转化率如图乙所示:
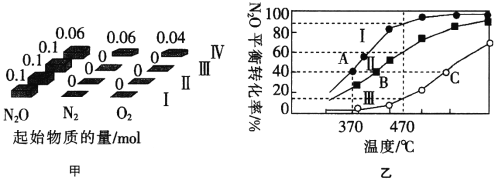
①该反应的△H______(填“>”或“<”)0。
②容器II的体积为0.5L,在470℃下进行反应,30s后达到平衡,0~30s内容器II中O2的反应速率为_______mol·L-1·s-1。
③已知容器I的体积为1L,370℃时,该反应的平衡常数k=________(保留两位有效数字)。
④图中A、B、C三点处容器内密度最大的点是________(填“A”“B”或“C”)。
-
依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是( )
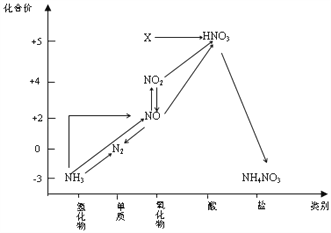
A. X是N2O5
B. 可用排水法收集NO、NO2气体
C. 工业上以NH3、空气、水为原料生产硝酸
D. 由NH3→N2,从原理上看,NH3可与NO2反应实现
-
依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是( )
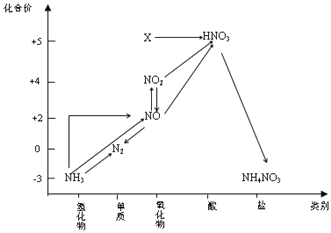
A. X是N2O5
B. 可用排水法收集NO、NO2气体
C. 工业上以NH3、空气、水为原料生产硝酸
D. 由NH3→N2,从原理上看,NH3可与NO2反应实现
-
依据下图中氮元素及其化合物的转化关系,判断下列说法不正确的是
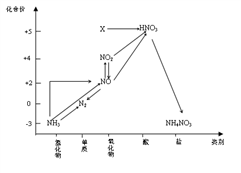
A. X是N2O5
B. 可用排空气法收集NO气体
C. 工业上以NH3、空气、水为原料生产硝酸
D. 由NH3→N2,从原理上看,NH3可与NO2反应实现
-
麻醉剂是外科手术的必需品,我国古代著名医学家华佗发明了“麻沸散”,作为外科手术时的麻醉剂;近代有英国化学家戴维发明的N2O(结构式为:NNO);而今二乙醚(C2H5OC2H5)和氯仿仍是全身麻醉最常用的麻醉剂,有关麻醉剂的叙述正确的是( )
A.若N2O结构与CO2相似,则N2O为直线形极性分子
B.乙醚与乙醇互为同分异构体
C.氯仿是一种常见溶剂,易溶于水
D.氯仿为甲烷的二氯取代物,在碱溶液中可发生水解
-
化学与生产、生活密切相关,下列说法不正确的是( )
A. 聚乙烯塑料可用作食品袋、餐具、地膜等
B. 苯可用作洗涤剂、有机溶剂、消毒剂、染料等
C. 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯
D. 生物柴油和石油分馏所得的柴油都是碳氢化合物组成的混合物

正(N2O)_______
逆(N2O)。(填“>”“<”或“=”)








