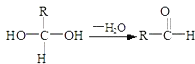-
最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺。这项技术具有广泛的能源潜在用途,包括为汽车提供原料、为潜水艇提供燃料等。该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气。合金中镓(Ga,ⅢA)是关键成分,可阻止铝形成致密的氧化膜。下列关于铝、镓的说法正确的是
A. 铝的金属性比镓强
B. 铝的熔点比镓低
C. Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应
D. 铝、镓合金与水反应后的物质可以回收利用冶炼铝
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法错误的是
A. 若120g石墨能写a个字,则平均每个字约含有 10NA/a个碳原子
B. 常温常压下,9mLH2O含有5NA个电子(水的密度为1g/mL)
C. 标准状况下,16g O2和O3的混合气体中含有的氧原子数目为NA
D. 0.1mol/L NaHSO4溶液中溶质离子总数为0.3NA
难度: 中等查看答案及解析
-
实验室常用王水(浓硝酸和浓盐酸按体积比1:3的混合物)来溶解白金等贵金属进行科学实验。王教授用质量分数为63%的浓硝酸(密度1.40g/
)和质量分数为36.5%的浓盐酸(密度1.19g/
)来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
A.该王水中硝酸的物质的量浓度是3.5mol/L
B.该王水中氧元素的质量是100.8g
C.该王水的密度约为1.24g/
D.该王水中HCl的质量分数约为26.2%
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:
D.最高价氧化物的水化物的酸性:
难度: 中等查看答案及解析
-
被称为万能还原剂的NaBH4(NaBH4中H为﹣1价)能溶于水并和水反应,有如下反应NaBH4+2H2O=NaBO2+4H2↑,下列有关该反应的说法中,正确的是( )
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量比为1:1
难度: 中等查看答案及解析
-
下列是对某溶液进行离子检测的方法和结论,其中正确的是( )
A. 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
B. 加入足量的CaCl2溶液,产生白色沉淀,则溶液中一定含有大量的CO
C. 加入NaOH溶液后加热产生有刺激性气味的气体,则溶液中一定含有大量的NH
D. 先加入适量的盐酸酸化,再加入AgNO3溶液,产生白色沉淀,则溶液中一定含有大量的Cl-
难度: 中等查看答案及解析
-
在容积可变的容器中发生反应N2+3H2
 2NH3,当缩小容器容积时,化学反应速率增大,其主要原因是
2NH3,当缩小容器容积时,化学反应速率增大,其主要原因是A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.活化分子百分数未变,但单位体积内的活化分子数增加,有效碰撞次数增多
D.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
难度: 中等查看答案及解析
-
关于烷烃性质的叙述中,不正确的是( )
A.烷烃同系物随相对分子质量增大,熔点、沸点逐渐升高;常温下的状态由气态递变到液态,相对分子质量大的则为固态
B.烷烃同系物都能使溴水、KMnO4溶液褪色
C.烷烃跟卤素单质在光照条件下能发生取代反应
D.烷烃同系物的密度随相对分子质量增大逐渐增大
难度: 中等查看答案及解析
-
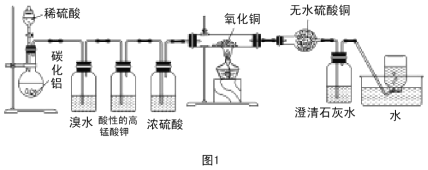
下列实验装置正确且能达到实验目的的是

A.证明非金属性氯>碳>硅(A、B、D中的试剂分别为盐酸、石灰石和硅酸钠溶液)
B.石油分馏
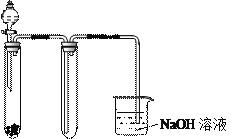
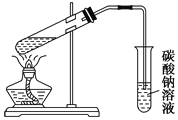
C.用KMnO4 与浓盐酸反应制取适量氯气的
简易装置
D.实验室制乙酸乙酯
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
己烯雌酚(结构简式如下图所示),是一种激素类药物。下列叙述不正确的是
A.己烯雌酚的分子式为C18H20O2
B.己烯雌酚与NaOH溶液、NaHCO3溶液均能反应
C.1 mol己烯雌酚最多能与2 mol Na发生反应
D.己烯雌酚与饱和溴水可以发生加成反应和取代反应
难度: 中等查看答案及解析
-
已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
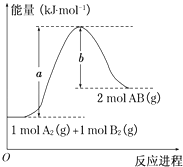
A.每生成2分子AB吸收b kJ热量
B.该反应热△H=+(a﹣b)kJ•mol﹣1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A﹣A和1 mol B﹣B键,放出a kJ能量
难度: 中等查看答案及解析
-
对于密闭容器中的可逆反应:mX (g) +nY(s)
pZ (g);ΔH<0,达化学平衡后,改变条件,下列表述不正确的是
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其它条件不变,升高温度,化学平衡一定发生移动
难度: 中等查看答案及解析
-
如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )
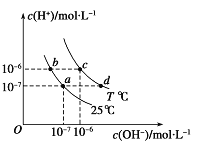
A. 只采用升温的方式,可由a点变成d点
B. T<25
C. b点和c点pH均为6,溶液呈酸性
D. 两条曲线上任意点均有c (H+) ×c (OH-)=Kw
难度: 中等查看答案及解析
-
一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为:C2H5OH+3O2===2CO2+3H2O,电池构造如下图所示。下列关于该电池的说法正确的是( )
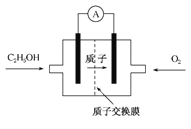
A.放电过程中,电源内部的H+从正极区向负极区迁移
B.通入乙醇的电极是正极
C.该电池的正极反应为:4H++O2+4e-===2H2O
D.用该电池做电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2 mol C2H5OH,阴极产生标准状况下气体的体积为13.44 L
难度: 中等查看答案及解析
-
下列叙述正确的是( )。
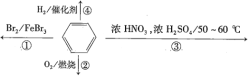
A.反应①为取代反应,有机产物与水混合后有机产物浮在上层
B.反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C.反应③为取代反应,有机产物是一种烃
D.反应④中1mol苯最多与3molH2发生加成反应,因为一个苯分子含有三个碳碳双键
难度: 困难查看答案及解析
-
两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示。下列有关混合气体的说法正确的是
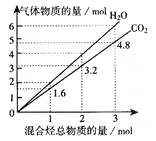
A.该混合气体中一定含有乙烯
B.该混合气体一定含有甲烷和乙炔
C.在110℃条件下,该混合气体与氧气混合,总混合气燃烧前后体积不变
D.若混合气体由CH4和C2H4组成,则其体积比为1∶3
难度: 困难查看答案及解析