-
元素周期表和元素周期律对与化学相关的科学技术具有指导作用,人们常在元素周期表中一定的区域内寻找特殊物质,其中寻找催化剂的区域为( )
A. 金属与非金属的分界线附近区域 B. 过渡元素区域
C. 氟、氯、硫、磷等元素附近区域 D. 元素周期表左下部分主族元素区域
难度: 简单查看答案及解析
-
氢气在氯气中燃烧时产生苍白色火焰,在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molCl2中的化学键消耗的能量为Q2 kJ,形成1molHCl中的化学键释放的能量为Q3kJ,下列关系式正确的是( )
A.Q1 + Q2 >Q3 B.Q1+ Q2 > 2Q3 C.Q1 + Q2 < Q3 D.Q1 + Q2 < 2Q3
难度: 简单查看答案及解析
-
2019年12月以来,我国部分地区突发的新型冠状病毒肺炎威胁着人们的身体健康。以下是人们在面对“新型冠状病毒肺炎”时的一些认识,你认为符合科学道理的是( )
A.家庭消毒时,消毒液越浓越好 B.吸烟、喝酒可以预防“新型冠状病毒”
C.应经常保持室内清洁卫生和通风 D.ClO2具有还原性,可用于自来水的杀菌消毒
难度: 简单查看答案及解析
-
一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中
和
代表不同元素的原子。
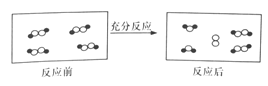
关于此反应说法错误的是
A.一定属于分解反应 B.一定属于可逆反应
C.一定属于氧化还原反应 D.一定属于吸热反应
难度: 简单查看答案及解析
-
下列反应既是氧化还原反应又是放热反应的是( )
A.氨水与稀硫酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2反应 D.过氧化钠与水反应
难度: 简单查看答案及解析
-
中学化学中很多“规律”都可以类推,下列根据有关“规律”推出的结论正确的( )
A.CO2为直线形分子,故CS2也为直线形分子
B.浓硫酸可以干燥HCl气体,故也可用浓硫酸干燥HI气体
C.Na在空气中燃烧会生成Na2O2,故Li在空气中燃烧也会生成Li2O2
D.卤族元素单质随核电荷数增加熔点升高,故碱金属单质熔点也随核电荷数增加而升高
难度: 中等查看答案及解析
-
某元素的原子最外层只有一个电子,它跟卤素相结合时,可形成的化学键( )
A.一定是共价键 B.一定是离子键
C.可能是共价键,也可能是离子键 D.上述说法都不正确
难度: 简单查看答案及解析
-
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法正确的是
A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X
B.X、Z两元素能形成原子个数比(X∶Z)为3∶1和4∶2的化合物
C.化合物YW2、ZW2都是酸性氧化物
D.用M、Mg、NaOH溶液组成原电池,其负极反应式为:Mg-2e-=Mg 2+
难度: 中等查看答案及解析
-
一定温度下,向a L密闭容器中加入1molX气体和2molY气体,发生如下反应:X (g)+2Y(g)⇌ 3Z(g),此反应达到平衡状态的标志是
A.容器内X、Y、Z的浓度比为1︰2︰3 B.容器内压强不再随时间而变化
C.容器内各物质的浓度不再随时间而变化 D.单位时间内消耗0.1molX的同时生成0.3molZ
难度: 中等查看答案及解析
-
已知镓和铝在周期表中位于同一纵行,氮化镓可把手机信号扩大10倍,让电脑的速度提高1万倍,将CD缩减到1英寸……,下列有关氮化镓的说法中正确的是( )
A.氮化镓是由主族元素与副族元素形成的化合物
B.氮化镓能把白铁变成黄金
C.氮化镓中氮元素显+3价
D.氮原子最外层比镓原子最外层多2个电子
难度: 简单查看答案及解析
-
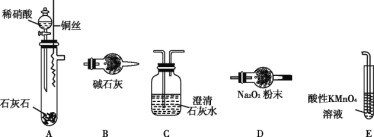
下列关于硝酸和硫酸的叙述中,错误的是( )
A.硫酸和硝酸都是重要的化工原料 B.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
C.稀硫酸和稀硝酸都具有氧化性 D.浓硝酸和浓硫酸都具有很强的腐蚀性、脱水性
难度: 简单查看答案及解析
-
水是最宝贵的资源之一。下列表述正确的是
A.因为水分子内存在氢键,所以水分子非常稳定
B.水分子中存在着共价键和氢键两种化学键
C.
分子中,各原子质量数之和是其质子数之和的两倍
D.水分子间存在的氢键属于化学键,导致水的沸点较高
难度: 简单查看答案及解析
-
对反应A(g)+2B(g) = 4C(g)+3D(g),以下化学反应速率的表示中,所表示反应速率最快的是( )
A.v (A)=0.40mol•L-1•s-1 B.v (B)=0.50mol•L-1•s-1
C.v (C)=0.36mol•L-1•s-1 D.v (D)=0.30mol•L-1•s-1
难度: 简单查看答案及解析
-
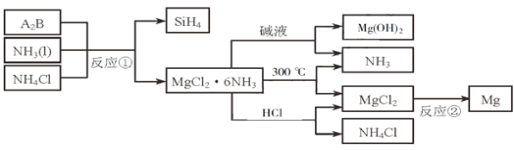
A是一种常见的单质,B、C为中学化学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是
A.X元素可能为Al
B.X元素不一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.NH4Cl固体与固体烧碱混合共热:
+OH-
NH3↑+H2O
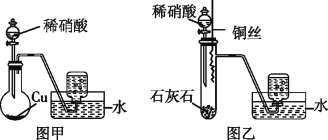
B.铜和稀硝酸的反应:Cu+4H++NO
=Cu2++NO↑+2H2O
C.Ba(OH)2和(NH4)2SO4溶液的混合加热:Ba2++2OH-+2
+
BaSO4↓+2NH3↑+2H2O
D.向氯化铁溶液中加入稀氨水:Fe3++3OH-=Fe(OH)3↓
难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.68LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗溶液NaOH的体积是( )
A.60mL B.45mL C.30mL D.15mL
难度: 中等查看答案及解析