-
化学与生产、生活和科技密切相关。下列说法正确的是
A.碳纳米管是一种比表面积大的有机合成纤维,可用作新型储氢材料
B.生产医用防护口罩的原料聚丙烯可以使溴水或酸性高锰酸钾溶液褪色
C.用于新版人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质
D.医用酒精消毒液中乙醇的体积分数为95%
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.标况下,11.2L CH2Cl2含极性共价键的数目为2NA
B.电解精炼铜时,若阳极质量减少64g,则电路中转移的电子数目为2NA
C.34g H2O2中含有的阴离子数为NA
D.向100mL 0.1mol·L-1醋酸溶液中加入CH3COONa固体至溶液刚好为中性,溶液中醋酸分子数为0.01NA
难度: 简单查看答案及解析
-
下列实验装置设计正确且能达到实验目的的是
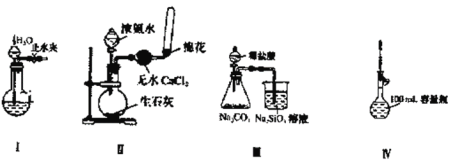
A.实验装置Ⅰ:检查装置的气密性
B.实验装置Ⅱ:制取收集氨气
C.实验装置Ⅲ:比较氯、碳、硅三种元素的非金属性强弱
D.实验装置Ⅳ:定容
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O=2HClO+
B.电解饱和MgCl2溶液:2Cl-+2H2O
2OH-+H2↑+Cl2↑
C.用Na2S2O3溶液吸收水中的Cl2:4Cl2+
+5H2O=10H++2
+8Cl-
D.将0.2mol·L-1的NH4Al(SO4)2溶液与0.4mol·L-1的Ba(OH)2溶液等体积混合:2Al3++3
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A.分子式符合C8H8的有机物都能使酸性高锰酸钾溶液褪色
B.存在立体异构的链烃中,碳原子数最少的一定是2-丁烯
C.葡萄糖与核糖互为同系物
D.C8H8O2芳香族化合物分子中可能含有两个醛基
难度: 简单查看答案及解析
-
镍能形成多种配合物如正四面体形的Ni(CO)4和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。下列说法正确的是
A.NH3的键角大于CCl4
B.固态Ni(CO)4属于离子晶体
C.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化
D.Ni(CO)4分子内σ键和π键个数之比为1∶1
难度: 中等查看答案及解析
-
用如图所示装置进行实验(a、b电极均为Ag单质),观察到了灵敏电流计指针发生偏转。下列说法正确的是
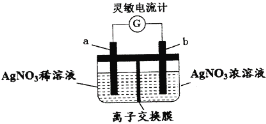
A.b极发生氧化反应
B.离子交换膜为阴离子交换膜
C.去掉离子交换膜,电流表仍然有电流通过
D.电流计指针不再偏转时,右边硝酸银溶液的物质的量浓度依然大于左边
难度: 中等查看答案及解析
-
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满,下列说法正确的是
A.简单的离子半径:X>Y>R>M
B.简单氢化物沸点:M>Y>R
C.氧化物对应水化物的酸性:Y>X
D.M、R、X、Y、Z的价电子数都分别等于它们的族序数
难度: 中等查看答案及解析
-
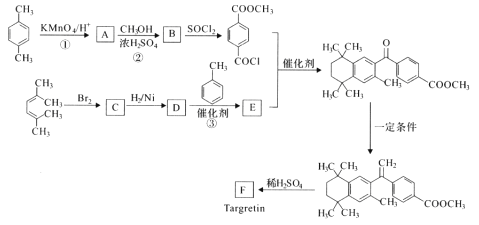
Y是合成香料、医药、农药及染料的重要中间体,可由X在酸性条件下反应得到:
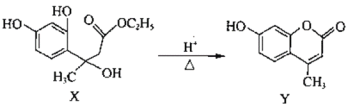
下列说法错误的是
A.X分子中所有碳原子不可能共平面
B.Y既可以发生加聚反应义可以与甲醛发生缩聚反应
C.X、Y分别与足量H2加成后的分子中均含有相同数目的手性碳原子
D.等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为4:3
难度: 简单查看答案及解析
-
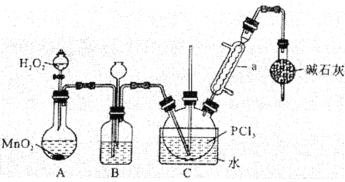
Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。
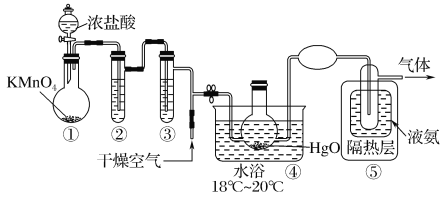
已知:Cl2O的熔点为-116℃,沸点为3.8℃,Cl2的沸点为-34.6℃;HgO+2Cl2=HgCl2+Cl2O
下列说法不正确的是( )
A.装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
难度: 中等查看答案及解析
-
高锰酸钾(KMnO4)是一种常用的氧化剂。不同条件下高锰酸钾可发生如下反应:
+5e-+8H+→Mn2++4H2O;
+3e-+2H2O→MnO2+4OH-;
+e-→
。高锰酸钾溶液与硫化亚铁有如下反应:FeS+KMnO4+H2SO4→K2SO4+MnSO4+Fe2(SO4)3+S+H2O(未配平)。下列有关说法正确的是
A.由上面的反应可知,高锰酸根离子(
)反应后的产物与溶液的酸碱性有关
B.高锰酸钾溶液可代替二氧化锰用来制取Cl2,氧化剂和还原剂物质的量之比为1:8
C.在高锰酸钾溶液与硫化亚铁的反应中,反应前后固体的质量减少了2.8g,则硫元素与高锰酸钾之间转移的电子数为0.15NA
D.高锰酸钾溶液也可与双氧水发生反应,其中双氧水是氧化剂
难度: 中等查看答案及解析
-
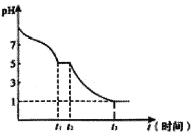
常温下,向20mL0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法错误的是
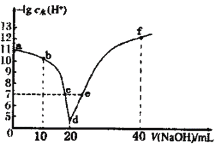
A.从d点以后至f点,H2O的电离程度一直减小
B.c、e两点溶液对应的pH=7
C.常温下,A-的水解平衡常数Kh约为1×10-9mol·L-1
D.b点的溶液呈酸性,粒子浓度之间存在:c(HA)+2c(H+)=2c(OH-)+c(A-)
难度: 中等查看答案及解析
-
CO2催化重整CH4的反应:(Ⅰ)
△H1,主要副反应:(Ⅱ)
△H2>0,(Ⅲ)
△H3<0。在恒容反应器中CH4和CO2按物质的量之比1:1充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法错误的是
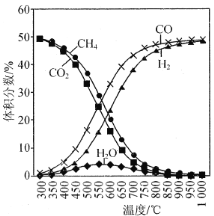
A.△H1>0
B.若反应Ⅰ、Ⅲ消耗等量的CO2时,转移电子数之比为3:4
C.300~580℃时,H2O的体积分数不断增大,是由于反应(Ⅲ)生成H2O的量大于反应(Ⅱ)消耗的量
D.T℃时,在2.0L容器中加入1molCH4、1molCO2以及催化剂进行重整反应,测得CO2的平衡转化率为50%,则反应(I)的平衡常数小于1
难度: 中等查看答案及解析
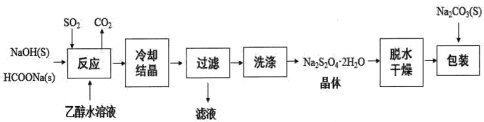
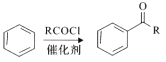
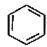
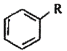
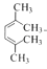 的名称_____________。
的名称_____________。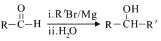 (R、R′表示烃基或芳基)。以2-溴丙烷和乙二醇为原料,选用必要的无机试剂合成
(R、R′表示烃基或芳基)。以2-溴丙烷和乙二醇为原料,选用必要的无机试剂合成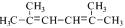 ,写出合成路线________。
,写出合成路线________。