-
下列表示物质结构的化学用语正确的是( )
A.氮气的电子式:
B.CO2的结构式为:O=C=O
C.S 2- 的结构示意图
D.甲烷分子的球棍模型:

难度: 简单查看答案及解析
-
已知元素Se位于第四周期ⅥA族,下列说法不正确的是
A.Se的原子序数为34
B.单质Se在空气中燃烧可生成SeO3
C.可形成Na2SeO3、Na2SeO4两种盐
D.H2S比H2Se稳定
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表,下列叙述正确的是( )
元素代号
X
Y
Z
W
Q
原子半径/pm
130
118
75
73
102
主要化合价
+2
+3
+5、-3
-2
+ 6、- 2
A.X、Y元素的金属性:X<Y B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.W、Q两种元素的气态氢化物的热稳定性:H2W>H2Q D.X的最高价氧化物对应的水化物的碱性弱于Y的
难度: 中等查看答案及解析
-
下列判断错误的是( )
A.Na2O2——有离子键和共价键 B.HCl气体溶于水——共价键被破坏
C.NaCl晶体溶于水——离子键被破坏 D.氢氧化钠熔化——离子键和共价键均被破坏
难度: 简单查看答案及解析
-
某元素的一种同位素X原子的质量数为A,它与2H原子组成2HmX分子,此分子含N个中子,在a g 2HmX中所含电子的物质的量是
A.
(A-N+m) mol B.
(A-N) mol
C.
(A-N+m) mol D.
(A-N+2m) mol
难度: 中等查看答案及解析
-
已知1克氢气完全燃烧成水蒸气放出121kJ,1 mol O=O键完全断裂吸收496 kJ,1 mol H—O键形成时放出463 kJ,则氢气中1 mol H—H键断裂时吸收能量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
难度: 简单查看答案及解析
-
a、b、c、d、e五种金属;将a与b用导线接起来,浸入电解质溶液中,a金属溶解;将a、d分别投入等浓度的盐酸中,d比a反应强烈;将铜浸入b的盐溶液里,无明显变化;把铜浸入c的盐溶液里,有c析出.金属阳离子氧化性:c<e;则活动性顺序由强到弱为
A.a>c>e>d>b B.d>a>b>c>e C.d>b>a>c>e D.e>d>a>b>c
难度: 中等查看答案及解析
-
锌–空气燃料电池可作电动车动力电源,电解质溶液为KOH溶液,放电时总离子方程式为2Zn+O2+4OH–+2H2O===2Zn(OH)42-,放电时下列说法正确的是
A.电解质溶液中K+向负极移动
B.电解质溶液中c(OH-)逐渐增大
C.负极电极反应:Zn+4OH–-2e–===Zn(OH)42-
D.转移4mol电子时消耗氧气22.4L
难度: 简单查看答案及解析
-
可逆反应2A(g)+3B(g)
2C(g)+D(g)在四种不同条件下的反应速率分别为:①υ(A)=0.5mol·L-1·s-1;②υ(B)=0.6mol·L-1·s-1;③υ(C)=0.35mol·L-1·s-1;④υ(D)=0.3mol·L-1·min-1,则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
难度: 简单查看答案及解析
-
恒温恒容时,能表示反应 2X(g)+2Y(s)
Z(g) 一定达到化学平衡状态的是
①X、Z 的物质的量之比为 2︰1
②Z 的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成 2nmol Z,同时生成 nmol X
⑤气体平均相对分子质量不变
⑥气体密度不再变化
A.①②③⑥ B.①③④⑤ C.②③⑤⑥ D.②④⑤⑥
难度: 简单查看答案及解析
-
少量铁片与l00mL 0.01mol/L的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 0.1mol/L盐酸
A.①⑥⑦ B.③⑤ C.③⑦⑧ D.③④⑥⑦⑧
难度: 简单查看答案及解析
-
将气体a通入溶液b中,溶液无明显变化的是( )
气体a
溶液b
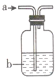
A
CO2
Na2SiO3
B
SO2
CaCl2
C
SO2
Ba(NO3)2
D
NO2
FeSO4
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
如图所示,将相同条件下的m体积NO和n体积O2同时通入倒立于水槽中且盛满水的试管内,充分反应后,试管内残留
体积的气体,该气体与空气接触后立即变为红棕色。则m与n的比值为( )

A.3∶2 B.2∶3 C.8∶3 D.3∶8
难度: 简单查看答案及解析
-
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为( )
A.0.2mol B.0.8mol C.0.6mol D.1.0mol
难度: 困难查看答案及解析
-
下列叙述不正确的是( )
A.有机物C2H6与C3H8一定是同系物 B.可以用溴水鉴别甲烷和乙烯
C.用分液漏斗分离乙酸和乙醇 D.蔗糖和麦芽糖互称为同分异构体
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.油脂不能发生水解反应
B.沸点由高到低:己烷>正丁烷>异丁烷
C.溴苯的所有原子不可能共平面
D.等物质的量的乙醇和水分别与足量的钠反应,生成的气体体积比为3:1
难度: 简单查看答案及解析